Диаграмма состояния (плавкости) двухкомпонентных систем с одной фазой переменного состава
Подобные диаграммы состояния характерны для систем, компоненты которых неограниченно растворимы в жидком состоянии (при смешении жидких компонентов образуются гомогенные растворы во всей области концентраций), но полностью нерастворимы в твердом состоянии (не образуют твердых растворов и химических соединений). Примерами таких систем являются Cd – Bi, KCl – LiCl. На рис. 10.4 представлена принципиальная схема диаграммы плавкости описанной системы, которую часто называют диаграммой состояния с простой эвтектикой. В случае, когда компоненты не образуют химических соединений и твёрдых растворов, добавки одного из компонентов всегда понижают температуру кристаллизации другого компонента, т. е. если к жидкому компоненту А добавить растворимый в нем компонент В, то температура начала кристаллизации такого расплава будет ниже температуры плавления чистого компонента А (явление понижения температуры замерзания растворов).
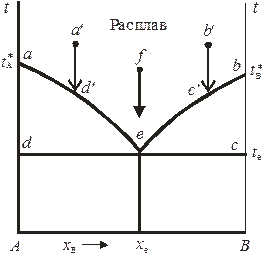
Рис. 10.4. Диаграмма плавкости двухкомпонентной системы
с простой эвтектикой.
На диаграмме 10.4 это понижение проявляется на кривых aе и bе – кривых ликвидуса, показывающих зависимости температуры начала кристаллизации смесей от состава. Выше линий ае и bе система может находиться только в расплавленном состоянии. Кривые ликвидуса для идеальных жидких растворов рассчитываются по уравнению Шредера
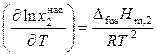 .
.
Точка е, являющаяся точкой пересечения кривых ликвидуса, называется эвтектической точкой, ей соответствует самая низкая температура кристаллизации смеси (эвтектическая температура te).
В эвтектической точке сосуществуют три фазы (чистые кристаллы А и В и расплав состава xе), поэтому в ней система инвариантна:
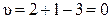 .
.
Затвердевшая смесь, соответствующая составу xе, называется эвтектической смесью или эвтектикой. При постоянном давлении температура и состав эвтектики постоянны и определяются только природой системы. При этом следут помнить, что эвтектика – не твердый раствор, а микрогетерогенная смесь кристаллов. Эвтектические смеси льда и неорганических солей называют криогидратами.
Линия, отвечающая температурам конца кристаллизации расплавов, называется линией (кривой) солидуса. На рис. 10.4 она представлена изотермой deс. Области диаграммы aеd и beс – гетерогенны. Если фигуративная точка находится в одной из этих областей, то система моновариантна и представлена двумя равновесными фазами: кристаллами одного из компонентов и жидким расплавом определенного состава. В гетерогенной области состав расплава зависит от температуры системы (уравнением связи между ними является уравнение Шредера или аналогичное ему уравнение для реальных растворов). Так, если охлаждать расплав, соответствующий точке a' (см. рис. 10.4), то вплоть до точки d ' система будет оставаться гомогенной. В точке d ' расплав становится насыщенным относительно компонента А и в системе появляются первые кристаллы твердой фазы (кристаллы А). При дальнейшем понижении температуры система остается гетерогенной, при этом состав расплава меняется с температурой по кривой ае. В точке е расплав становится насыщенным и относительно компонента В, поэтому при эвтектической температуре система трехфазна и инварианта. При последующем понижении температуры кристаллизуется эвтектическая смесь. При охлаждении расплава состава xe от температуры, соответствующей точке f, система вплоть до точки е остается однофазной. Если же исходить из точки b', то в точке c' в системе появляются кристаллы В, а при дальнейшем понижении температуры состав равновесного с кристаллами В расплава изменяется по кривой be. Таким образом, поле диаграммы Adexе представляет собой область существования системы в виде твердых смесей кристаллов А и эвтектики, а поле xеecB – в виде твердых смесей кристаллов В и эвтектики.
10.3.2. Диаграммы состояния двухкомпонентных систем с неограниченной взаимной растворимостью компонентов в жидком и твёрдом состояниях
Принципиальная диаграмма состояния системы с неограниченной растворимостью компонентов в жидком и твердом состояниях представлена на рис. 10.5. Такие диаграммы состояния характерны для систем, компоненты которых могут образовывать не только жидкие, но и твердые растворы во всей области концентраций. На приведенной диаграмме верхняя кривая (кривая ликвидуса) описывает зависимость температуры кристаллизации от состава расплава, нижняя кривая (кривая солидуса) — зависимость температуры плавления от состава твердого раствора. Если исходить из точки а' (расплав состава na) и понижать температуру, то в точке а расплав будет предельно насыщен относительно твердого раствора состава nb, соответствующего точке b.
В случае неидеальности жидкого раствора, образуемого компонентами, на диаграмме состояния могут появляются экстремумы: например, на диаграммах состояния систем Сu – Au и Сo – Cr есть минимумы температуры плавления.
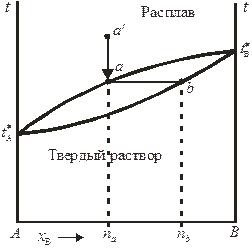
Рис. 10.5. Диаграмма плавкости бинарной системы с неограниченной
взаимной растворимостью компонентов в жидком и твердом состояниях
Твердые растворы образуются при кристаллизации жидких расплавов или при растворении газов в твердых веществах. Наиболее распространены твердые растворы замещения и внедрения, различающиеся по расположению растворенного вещества в кристаллической решетке растворителя.
При образовании твердых растворов замещения сохраняется структура кристаллической решетки растворителя, при этом атомы, молекулы или ионы в ее узлах замещаются частицами другого вещества. Существование таких растворов возможно, если оба вещества имеют не только близкие по структуре кристиллические решетки, но и близкие валентности, электроотрицательности и размеры частиц. По приближенному правилу В. Юм-Розери твердые растворы замещения образуются в тех случах, когда размеры частиц двух веществ отличаются не более чем на 15 %. Компоненты, образующие такие растворы, часто неограниченно растворимы друг в друге (т. е. образуют непрерывный ряд твердых растворов). Тип решетки и число частиц в кристаллической решетке остаются неизменными, но изменяются ее объем и плотность. Примерами систем с непрерывным рядом твердых растворов замещения являются Ag – Au, Au – Cu, KCl – KBr.
Твердые растворы внедрения получаются путем внедрения частиц растворенного вещества в междоузлия кристаллической решетки растворителя и образуются в тех случах, когда размеры частиц внедряемого вещества В меньше размеров частиц растворителя А. Обычно выполняется следующее соотношение:
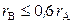 .
.
Подобные растворы возникают при растворении неметаллов (углерода, кислорода, бора, кремния и т.д.) в металлах. Поскольку внедрение новых частиц в промежутки между атомами металла сопровождается деформацией кристаллической рещетки, то область существования твердых растворов внедрения ограничена (компоненты образуют прерывный ряд твердых растворов) и, как правило, невелика. Число частиц в элементарной кристаллической ячейке и ее объем при образовании таких растворов увеличиваются.
Дата добавления: 2015-08-20; просмотров: 2528;
