Диаграммы равновесия однокомпонентных систем
Для описания состояния закрытой однокомпонентной системы достататочно трех переменных: температуры, давления и молярного объема (или обратной ему величины – молярности). Поэтому диаграмма состояния такой системы представляет собой пространственную диаграмму, построенную в прямоугольных осях координат: по одной оси откладываются значения температуры, по другой – значения давления, по третьей – молярный объем. Если система гомогенна, то с помощью одной выбранной фигуративной точки фазы задаются как условия существования системы (температура и давление), так и отвечающий этим условиям молярный объем системы. Если система гетерогенна (распадается на несколько фаз), то фигуративная точка системы описывает лишь усредненный молярный объем вещества во всей системе. Каждой фазе в этом случае соответствует своя особая фигуративная точка и состояние всей системы описывается совокупностью нескольких фигуративных точек отдельных фаз. Фигуративные точки, охватывающие все возможные сочетания Р, V и Т вещества в данной фазе, образуют некоторую поверхность, называемую полем существования данной фазы. Сочетания подобных полей и образуют объемную диаграмму состояния.
Объемная диаграмма состояния слишком громоздка и недостаточно удобна в работе, поэтому на практике вместо полной объемной диаграммы пользуются ее проекциями на одну из трех плоскостей, проходящих через оси координат. Чаще всего пользуются проекцией, построенной в координатах давление – температура. Данная проекция позволяет ответить на вопрос, в каком состоянии находится вещество при заданных условиях (Т и Р). Молярные объемы фаз на этой проекции никак не отражаются, они должны быть рассчитаны (при необходимости) из термического уравнения состояния.
По правилу фаз Гиббса для однокомпонентной системы (К = 1):
1. Если Ф = 1, то υ = 2 и давление и температуру можно изменять произвольным образом.
2. Если Ф = 2, то υ = 1, следовательно, давление может изменяться независимо, а температура – нет, она становится функцией давления (зависимым параметром): Т = f (Р).
3. Если Ф = 3, то υ = 0 и температура и давление строго определены. Малейшее изменение любой из этих величин приведёт к исчезновению одной или двух фаз.
На рис. 10.1 приведена диаграмма состояния воды (проекция давление – температура) в области низких и средних давлений и температур, на которой выделяются три области существования льда, жидкости и пара. Рассмотрим эту диаграмму более подробно.
1. Однофазным системам на плоской диаграмме состояния отвечают области (поля) диаграммы, заключенные между двумя кривыми двухфазных систем. В таких системах можно изменять одновременно и независимо друг от друга температуру и давление, не изменяя числа и вида фаз в системе (υ = 2 при Ф = 1).
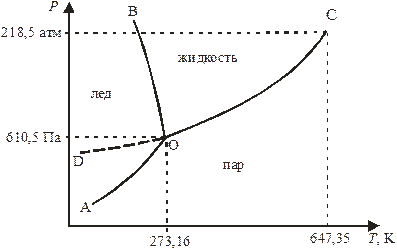
Рис. 10.1. Диаграмма состояния воды при невысоких давлениях (схема).
2. Двухфазные системы представлены на плоскости линиями, разграничивающими поля диаграммы состояния. Так, кривая ОC (линия испарения) отвечает равновесным системам, состоящим из жидкости и пара; кривая ОА (линия сублимации, или возгонки) – равновесным системам, состоящим из пара и льда; и кривая ОB (линия плавления) – равновесным системам, состоящим из льда и жидкой воды. Число степеней свободы в таких системах равно
υ = 1 + 2 – 2 = 1,
т. е. можно изменять одну из переменных величин (P или Т), не изменяя числа и вида фаз в системе. Такие системы называются двухфазными одновариантными (моновариантными).
Кривые ОС и ОА представляют собой зависимость давления насыщенного пара над жидкой водой и льдом, соответственно, а линия ОВ – зависимость температуры плавления льда от давления. Для воды (как и для галлия, висмута и некоторых других веществ) характерен наклон линии ОВ влево, что отвечает понижению температуры плавления льда (модификация I) при повышении давления.
Кривая ОD является продолжением кривой ОC и определяет давление пара над переохлажденной жидкой водой. На участке ОD вода и пар находятся в «чуждой» им области – метастабильном состоянии (состоянии, отвечающем неустойчивому равновесию). Химический потенциал переохлажденной жидкой воды больше, чем для льда при той жетемпературе, поэтому она самопроизвольно переходит в более стабильное состояние – кристаллическое.
Линия испарения ОС заканчивается критической точкой С, соответствующей состоянию равновесной двухфазной системы, где все термодинамические свойства жидкости и пара тождественны (исчезают различия между жидкостью и паром). Выше критической температуры (температура критической точки С) вода не может быть жидкой ни при каких давлениях.
3. Трехфазная система представлена точкой сосуществования льда, жидкости и пара – тройной точкой О с координатами Т = 273,16 К и Р = 610,5 Па. Для этой точки Ф= 3 и υ= 0. Значения P и T строго определены, система нонвариантна. Повышение температуры при постоянном давлении или понижение давления при постоянной температуре переводит систему в состояние пара. Повышение давления при постоянной температуре переводит систему в состояние жидкой воды, а понижение температуры при постоянном давлении – в состояние льда.
Следует отметить, что при высоких давлениях для воды установлено существование еще семи кристаллических модификаций (льда), из которых четыре могут находиться в устойчивом равновесии с жидкой водой. Интересно, что температуры плавления модификаций льда III, V, VI и VII повышаются с увеличением давления, поскольку для них
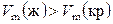 ,
, 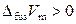 ,
, 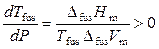 .
.
Рассотрим в качестве примера и диаграмму состояния углекислого газа (рис. 10.2), которую анализируют тем же образом, что и диаграмму состояния воды. На указанной диаграмме:
АО – линия возгонки, соответствующая процессу CO2(тв) ↔ CO2(г);
ОB – линия плавления, соответствующая процессу CO2(тв) ↔ СО2(ж);
ОC – линия испарения, соответствующая процессу CO2(ж) ↔ СО2(г);
О – тройная точка, отвечающая равновесию между тремя фазами. Координаты тройной точки диоксида углерода: Т = 216,55 К, Р = 5,11 атм.
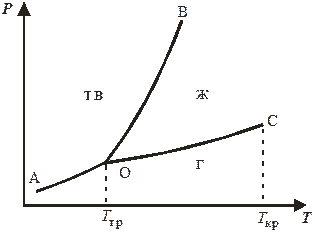
Рис. 10.2. Диаграмма состояния диоксида углерода (схема).
Важным отличием диаграммы состояния углекислого газа от диаграммы состояния воды является наклон кривой плавления (ОB). В отличие от кривой плавления воды (которая наклонена влево), кривая плавления углекислого газа имеет наклон вправо. При увеличении внешнего давления температура плавления углекислого газа увеличивается.
Несколько более сложные диаграммы состояния имеют вещества, образующие несколько кристаллических модификаций: например, сера, фазовая диаграмма которой представлена на рис. 10.3. Для таких веществ характерно наличие метастабильных двухфазных и трехфазных равновесий (метастабильные системы – системы, находящиеся в состоянии относительной устойчивости). Например, быстрый нагрев ромбической серы приводит к тому, что при температуре твердофазного перехода она переходит в перегретое метастабильное состояние, а не превращается в моноклинную модификацию. Если же моноклинная сера нагревается до температуры плавления, то ее перегрев невозможен – дальнейшее подведение теплоты приводит к немедленному разрушению кристаллической решетки.
На диаграмме состояния серы (см. рис. 10.3):
1. Стабильным однофазным системам сответствуют четыре области: выше и левее кривой ABDE (ромбическая сера Sромб), BDCB (моноклинная сера Sмон ), правее и выше кривой EDCK (жидкая сера Sж) и ниже кривой АВСК (газообразная сера Sг).
2. Двухфазным стабильным системам соответствуют кривые АВ (Sромб ↔ Sг), ВС (Sмон ↔ Sг), СК (Sж ↔ Sг), ВD (Sромб ↔ Sмон), CD (Sмон ↔ Sж) и DE (Sромб ↔ Sж).
3. Трехфазным стабильным системам соответствуют три тройные точки: В (Sромб ↔ Sмон ↔ Sг), С (Sмон ↔ Sж ↔ Sг), D (Sромб ↔ Sмон ↔ Sж).
4. Двухфазным метастабильным системам соответствуют следующие пунктирные кривые: ВО, отвечающая равновесию Sромб (перегретая) ↔ Sг (пересыщенная относительно Sмон), ОС – для равновесия Sж (переохлажденная) ↔ Sг (пересыщенная относительно Sмон) и OD – для системы Sромб (перегретая) ↔ Sж (переохлажденная).
5. Тройная точка О соответствует метастабильной трехфазной системе Sромб (перегретая) ↔ Sж (переохлажденная) ↔ Sг (пересыщенная относительно Sмон ). В указанной точке химические потенциалы всех трех неустойчивых фаз равны и превышают химический потенциал наиболее устойчивой для этой области модификации – моноклинной серы.
6. Однофазным метастабильным бивариантным системам соответствуют поля BOD (перегретая Sромб ), COD (переохладенная Sж ) и BOC – (пересыщенная относительно Sмон газообразная сера Sг ).
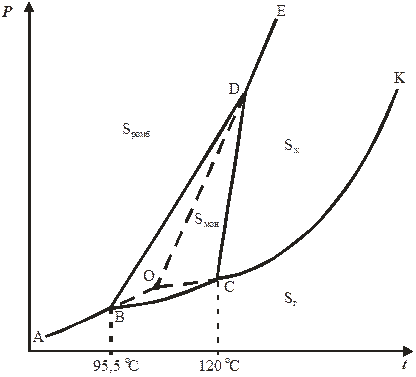
Рис. 10.3. Диаграмма состояния серы (схема).
Энантиотропные и монотропные превращения. Когда вещество может существовать в нескольких (двух и более) кристаллических формах, то имеется температура перехода, выше которой устойчивой является одна из модификаций, а ниже – вторая. Если при температуре перехода превращение одной твердой модификации в другую может самопроизвольно протекать как в прямом, так и в обратном направлениях, то переход называется энантиотропным. Энантиотропные превращения наблюдаются только в таких системах, для которых температура взаимного перехода модификаций меньше температур плавления этих кристаллических форм. Пример энантиотропного превращения – переход ромбическая сера (Sромб) ↔ моноклинная сера (Sмон) при Тtr = 95,5 °С.
Гораздо реже встречаются системы, где самопроизвольные превращения одной кристаллической модификации в другую при любых условиях идут только в одном направлении (односторонние превращения). Превращения такого типа называются монотропными. В таких системах переход от высокотемпературной к низкотемпературной модификации напрямую не происходит, тогда как обратный переход осуществляется и протекает тем быстрее, чем выше температура. Примером такого превращения может служить переход белый фосфор (Рбел) ↔ красный фосфор (Ркрасн) при Тtr = 44 °С.
Дата добавления: 2015-08-20; просмотров: 3589;
