Лекция № 4. Белки могут быть олигомерными, т.е
Белки могут быть олигомерными, т.е. состоять из нескольких полипептидных цепей. Полипептидные связи в молекуле ковалентные, цистеидные. Склонны к процессу окисления:
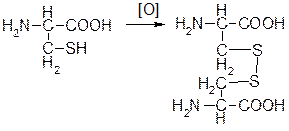
Если хотя бы 2 цистеина, то они взаимодействуют и образуют дисульфитные мостики. Чтобы отделить одну полипептидную связь, нужно провести:
Методы идентификации полипептидной связи:
1. Окисление с разрывом этой связи:
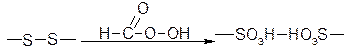
2. Метод Анфинцена, по этому методу белковю молекулу обрабатывают тиоэтаноламином:
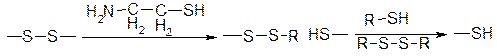
Методы определения аминокислот с N-конца и с С-конца:
1. Метод определения N-конечной аминокислоты, метод Сенджера, (он был первый, который в 1953 году определил последовательность аминокислот в белке инсулине, за что и получил нобелевскую премию, затем в 1977 году получил вторую нобелевскую премию за определение последовательности нуклеотидов в молекуле ДНК). В методе полипептид обрабатывают динитрофторбензолом:
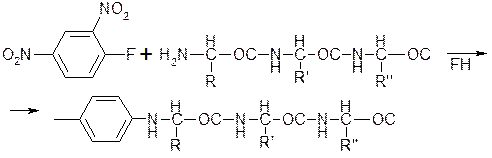
Дансилхлорид:
1-диметил-амино-5-нафтил сульфохлорид
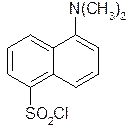
2. Метод определения одной аминокислоты с С-конца, определяют ферментом карбоксипептидазой, он отщепляет конечную аминокислоты сразу. С помощью этого фермента можно многократно отщеплять по одной аминокислоте с С-конца. Гидразинолис – действие гидразин гидратом. Гидразин взаимодействует со свободной гидроксильной группой. Получается, что все пептидные связи после расщепления дают аминокислоты, связанные с гидразином – гидразиды. С помощью гидразинолиза происходит отщепление полипептида и определение С-конечной аминокислоты.
3. Метод Эдмана для многократного определения аминокислот с N-конца последовательно. На полипептид действует фенилтиоизоцианатом. Фенилгедантоиновое производное аминокислоты. таким образом можно определить несколько десятков аминокислот. Эдман на основании этого метода разработал прибор – секвинатор. С помощью этого прибора удалось расшифровать последовательность первых 60 кислот в миоглобине кита.
4. Для больших молекул проводят ферментативное расщепление на фрагменты, т.е. длинную полипептидную цепочку с помощью специфического фермента, который отщепляет вполне определенном месте (например, фермент трипсин, расщепляющий полипептид по карбонильной группе аргинина и лизина).
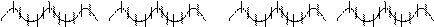
Затем определяют аминокислотную последовательность в каждом фрагменте. Потом снова берут полипептидную цепочку и расщепляют другим методом. Например реагентом бромцианом, который расщепляет полипептидные цепи, где есть кислота метионин со стороны карбоксильной группы, хроматографически определяют аминокислотную последовательность в каждом фрагменте. Смотрят перекрывающиеся участки первого и второго расщепления. Если недостаточно двух расщеплений, могут использовать больше, для этого есть свои специальные ферменты
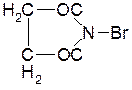
н-бромсукцинимид – расщеплет по остаткам триптофана,
гидроксиламин – расщепляет полипептид между аспарагиновой кислотой и глицином.
В настоящее время для выяснения первичной последовательности белков существует много методов и приемов, все зависит от технической оснащенности лабораторий и времени. Для полного выяснения природы необходимо ~ 0,2 мг белка. В настоящее время ~ 2000 белков уже исследовано. Самый крупный белок с определенной первичной структурой – иммуноглобулин, в 4-х полипептидных цепях содержится 1300 аминокислотных остатков.
Первичная структура полипептидной цепи у разных биологических видов невполне одинакова – это так называемая видовая специфичность. Сенджер и его сотрудники, работали с препаратами инсулина, выделенными от разных видов животных и во всех случаях обнаружили те или иные вариации. Белки, которые у разных видов выполняют одинаковые функции, называются гомологическими белками, например белок гемоглобин (переносчик кислорода), инсулин (регулятор глюкозы). В белках на определенных позициях находятся одинаковые аминокислоты - это инвариантные остатки, они отвечают за биологическую активность данного белка. Вместе с тем наблюдаются различия в положениях аминокислот, они варьируют от вида к виду – это вариабельные остатки. Чем больше вариабельных остатков в полипептидных цепях, тем более далеки по филогенетическому различию виды.
У всех исследованных белков у всех видов оказалось что из 104 звеньев 27 инвариантных остатков, остальные могут варьировать. Цитохром-С лошади и цитохром-С дрожжей насчитывает различия в 46 положениях. Исследуя последовательность белков строят древо гомологичных рядов разных видов.
Различия между гомологическими белками можно выявить по иммунной реакции. Молекулы антител иммуноглобулина появляются у позвоночных в стеке ткани в ответ на инъекцию антигена. Подобная реакция организма называется иммунным ответом. Антитела представляют собой молекулы U-образной формы состоящие из 4 полипептидных цепей, у них имеются участки связывания антигена – это комплемнтарные участки с определенной химической структурой. Каждое антитело специфично к своему антигену. Пептидная группа имеет жесткую планарную структуру.
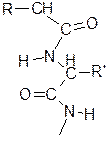 Сама полипептидная цепочка будет влиять на величину фи и пси. Полинг и Кори доказали, что может существовать две упорядоченные структуры полипептидной цепи. В зависимости от углов фи и пси возможна либо аольфа-спираль либо бета-складчатый слой.
Сама полипептидная цепочка будет влиять на величину фи и пси. Полинг и Кори доказали, что может существовать две упорядоченные структуры полипептидной цепи. В зависимости от углов фи и пси возможна либо аольфа-спираль либо бета-складчатый слой.
СН-С = 1,53 А ( 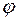 )
)
С=О = 1,23 А
С – N = 1,32 А
N – CH = 1,47А (  )
)
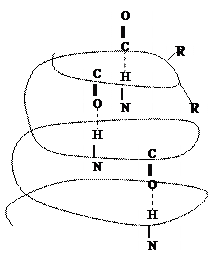 Неупорядоченных структур может быть бесчисленное множество. В последнее время выделяют третью упорядоченную структуру, характерную для белка калогена – калогеновая спираль.
Неупорядоченных структур может быть бесчисленное множество. В последнее время выделяют третью упорядоченную структуру, характерную для белка калогена – калогеновая спираль.
Таким образом, расположение белков в пространстве – это вторичная структура. Полинг и Кори показали, что альфа-спираль напоминает резьбу винта. На один виток спирали приходится 3,6 аминокислотных остатка. Стабилизирована спираль водородными связями, которые образуются между карбонильной группой и NH-группой. Спираль жесткая, разрыв одной водородной связи не приводит к разрушению структуры. Когда образуется спираль, радикалы аминокислот находятся снаружи.
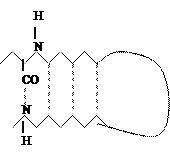 Бета-складчатый слой – это длинные вытянутые полипептидные цепи, которые могут образовывать изгиб или так называемую шпильку, структура тоже стабилизирована водородными связями.
Бета-складчатый слой – это длинные вытянутые полипептидные цепи, которые могут образовывать изгиб или так называемую шпильку, структура тоже стабилизирована водородными связями.
Некоторые белки имеют супервторичные структуры или сверхвторичные структуры, так называемые домены. В которых альфа-спираль и бета-структурные участки могут взаимодействовать между собой, образую ансамбли (например, белки эпидермиса кожи). Домены присущи крупным глобулярным белкам, они представляют собой структурно и функционально обособленные области молекулы, соединенные короткими участками полипептидной цепи, называемыми шарнирными участками.
Колагеновая спираль, его особенность, что треть всех аминокислот в ней глицин (поворот вокруг H атома совершается легко), кроме этого в коллагене очень много пролина (имеет не NH, которая образует водородную связь, а просто N).
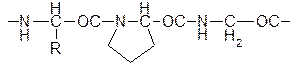
У человека треть всех белков в нашем организме – это коллаген – производитель клея, очень важен в формировании развивающихся тканей. Коллаген – это почти единчтвенный белок, который содержит оксипролин и оксилизин. На образование оксипролина и оксилизина положительную роль оказывает Витамни-С. Если витамина-С в организме недостает то образующийся коллаген становится недогидроксилизированным.
Процесс гидроксилирования пролина и лизина происходит уже в готовой полипептидной цепочки. Под действием фермента пролилгидроксилаза, фермент способствует гидроксилированию пролина и этот фермент содержит в активной форме железо +2, которое легко может переходить в железо +3, тогда этот фермент будет неактивным и процесс гидроксилирования не пойдет.

Лизилгидроксилаза тоже гидроксилирует со стороны глицина.
Дата добавления: 2015-08-20; просмотров: 1604;
