ОСНОВЫ МАССОПЕРЕДАЧИ
Технологические процессы, скорость которых определяется скоростью переноса вещества из одной фазы в другую, называются массообменными (диффузионными) процессами.
Движущая сила массоо6менных процессов – разность концентраций.
К массообменным процессам относятся:
абсорбция – процесс избирательного поглощения компонентов из газовых или парогазовых смесей жидкими поглотителями (абсорбентами);
ректификация – процесс разделения однородных жидких смесей, не находящихся в термодинамическом равновесии, на компоненты в зависимости от их летучести при противоточном взаимодействии жидкости и пара;
экстракция (жидкостная) – процесс извлечения вещества, растворенного в одной жидкости, другой жидкостью, не растворимой и не смешивающейся с первой;
экстрагирование – процесс извлечения компонента из твердого вещества с помощью растворителя;
адсорбция – процесс избирательного поглощения компонентов из газов, паров или растворенных в жидкостях веществ твердыми поглотителями (адсорбентами). Разновидностью адсорбции является ионный обмен – процесс извлечения вещества из раствора, основанный на способности некоторых твердых веществ (ионитов) обменивать свои подвижные ионы на ионы извлекаемого вещества;
сушка – процесс удаления влаги из твердых влажных материалов путем ее испарения и отвода образовавшихся паров.
кристаллизация – процесс выделения компонента из растворов или расплавов в виде твердой фазы (кристаллов);
растворение – процесс перехода твердой фазы в жидкую (растворитель);
мембранное разделение – процесс разделения находящихся в однородных растворах веществ, основанный на способности некоторых тонких пленок (мембран) пропускать одни вещества и задерживать другие.
Все перечисленные процессы характеризуются переходом вещества из одной фазы в другую и называются массопередачей.
Механизмом массопередачи является молекулярная, или конвективная, диффузия. Процесс осуществляется в направлении равновесия и прекращается при его достижении.
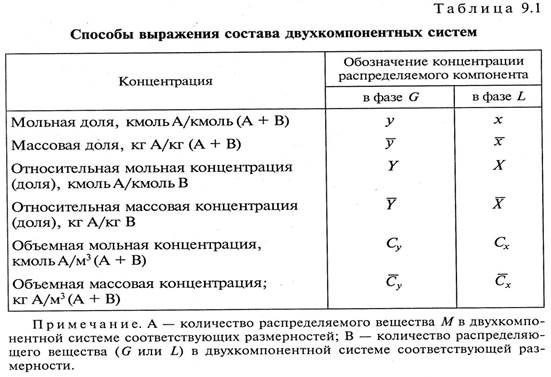
В массоо6менных процессах участвуют как минимум три вещества. Два из них (распределяющие вещества, или фазы) обменивают между собой содержащуюся в них третью (распределяемое вещество). Распределяющие вещества не участвуют в процессе массопередачи, а являются носителями распределяемого вещества, и их количество в процессе взаимодействия не изменяется (G= const и L = const).
Первую и вторую распределяющие фазы, а также их расход принято обозначать G и L. Распределяемое вещество и его количество обозначается буквой М. Концентрацию вещества М в фазе G принято обозначать у(Су), а в L – х(Сx).
Некоторые способы выражения состава фаз двухкомпонентных систем представлены в табл. 9.1.
Поскольку уравнения, описывающие конкретные массоо6менные процессы, могут записываться с использованием различных размерностей концентраций, в каждом случае они будут оговариваться особо.
Концентрация компонента в газовой смеси может быть выражена также через его парциальное давление, т. е. через давление газа, входящего в состав газовой смеси, которое он оказывал бы при рассматриваемой температуре, занимая один весь объем смеси.
Равновесие массообменного процесса есть такое термодинамическое состояние системы, при котором скорости перехода распределяемого вещества из одной распределяющей фазы в другую равны.
В общем случае связь между составом фаз при равновесии может быть выражена зависимостями
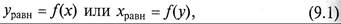
где уравн и хравн - равновесное содержание компонента распределяемого вещества в соответствующей распределяющей фазе, выраженное через его содержание в противоположной фазе. Знание равновесных концентраций позволяет определить направление течения процесса.
Графическое выражение зависимости (9.1) называется линией равновесия.
Все массообменные процессы в зависимости от температуры, давления и других условий являются обратимыми, т. е. могут протекать как в прямом, так и в противоположном направлениях.
Дата добавления: 2015-08-14; просмотров: 2164;
