Расчет констант равновесия в идеальных растворах.
Идеальными называются растворы, в которых отсутствует межмолекулярное взаимодействие и они подчиняются законам Рауля и Генри.
Закон Рауля: относительное понижение парциального давление пара растворителя над разбавленным раствором не электролита равно мольной доле растворенного вещества.
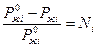 ,
,
где 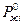 - давление насыщенного пара растворителя над чистым растворителем;
- давление насыщенного пара растворителя над чистым растворителем;
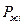 - давление насыщенного пара над раствором.
- давление насыщенного пара над раствором.
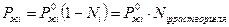
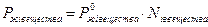
Закон Генри: в предельно разбавленных растворах парциальное давление пара над раствором пропорционально растворимости компонента:
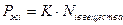 ,
,
где K – постоянная или константа Генри.
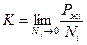
Рассмотрим раствор как идеальную систему, не выделяя растворитель и растворенное вещество. Тогда:
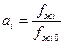 .
.
Для жидкости стандартным является такое состояние, когда этот компонент находится в виде чистой жидкости при стандартных условиях.
Для идеальных растворов фугитивность компонента практически не отличается от парциального давления и пропорционально мольной доле компонента в растворе.
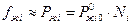
Поэтому:
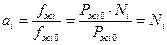
 .
.
Поэтому в жидкой фазе константа равновесия может быть выражена и легко посчитана через KN.
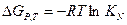
Это уравнение справедливо для растворов углеводородов, их галоген производных, а в меньшей степени для простых эфиров, сульфидов, кетонов, альдегидов и меркаптанов.
Существует способ с использованием справочной литературы, поскольку:
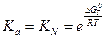 .
.
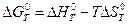 ,
,
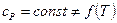 .
.
Либо при отсутствии справочных данных:
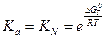
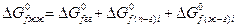
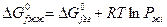
Ограничения, которые накладываются на последний метод. Это метод справедлив только тогда, когда растворенные вещества находятся в сольватированном виде и не оказывают влияние друг на друга.
Соотношение между KP и KN.
KN – константа равновесия в жидкой фазе.
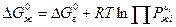
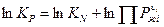
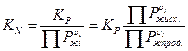
Более простым путем для расчета KN является определение KP, умноженное на отношение произведения равновесных давлений паров над чистыми жидкими реагентами к произведению равновесных давлений паров над чистыми жидкими продуктами.
Дата добавления: 2015-08-14; просмотров: 1069;
