Использование термодинамических данных для обоснования выбора условий проведения процесса.
A + B ↔ C + D
Для такой обратимой реакции необходимо определить термодинамическую функцию ΔG, чтобы определить условия проведения процесса.
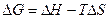
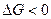
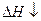
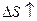
Для практического использования подставляются значения ΔH иΔS.
CO + NH3 ↔ HCN + H2O
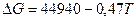
Смотрят примерную область температур, при которых можно проводить эту реакцию. Для любых температур эта реакция неосуществима в промышленных условиях. Затем записывают по стадийно:
CO + NH3 ↔ HCONH2
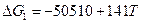
HCONH2 ↔ HCN + H2O
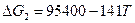
а. Величина ΔG будет меньше нуля в интервале температур от 0 К до 358 К. Повышение давления будет способствовать смещению равновесия вправо.
б. Величина ΔG будет иметь отрицательный знак при температуре выше 676 К. Понижение давления будет способствовать смещению равновесия вправо.
Процесс проводят в двух реакторах, условия в которых противоположны. В первом – снижение температуры и повышения давления. Во втором – повышение температуры и снижение давления.
Дата добавления: 2015-08-14; просмотров: 995;
