Термодинамика химических реакций
Химическая термодинамика изучает применение законов термодинамики к химическим и физико-химическим процессам. Сама термодинамика подразделяется на 3 составляющих:
1. Термохимия, которая рассматривает энергетические эффекты реакции на основе первого начала термодинамики.
2. Изучение термодинамических функций. Изменение которых определяет устойчивость системы, направление самопроизвольного протекание процесса и равновесие на основе второго начала термодинамики.
3. Изучение констант равновесия и расчет концентраций участников реакций в момент равновесия на основании второго и третьего законов термодинамики.
Первый закон термодинамики – закон сохранения энергии: энергия не исчезает никуда и не возникает ниоткуда, а просто переходит из одной формы в другую.
Закон Гесса: если химический процесс осуществляется без изменения давления и температуры и в отсутствии полезной работы, то количество энергии, которая система выделяет или поглощает в форме теплоты равно изменению энтальпии системы.
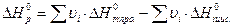
Второй закон термодинамики: невозможна самопроизвольная передача теплоты от более холодного тела к более тёплому. То есть, этот закон говорит, что для необратимых процессов: 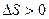 .
.
Третий закон: при приближении к абсолютному нулю энтропии чистых тел в конденсированном состоянии равна нулю.
При постоянной температуре и объеме процесс описывается функцией Гельмгольца (изохорно-изотермический) T = const, V = const:
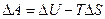
Обычно пользуются уравнением Гиббса, так как большинство химических реакций идут при постоянном давлении T = const, P = const (изобарно-изотермический):
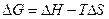 .
.
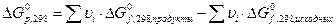
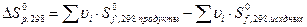
За стандартное состояние вещества принимается состояние вещества в виде идеального газа (для газов и паров) при стандартных условиях.
Для жидкостей и кристаллов за стандартное состояние принимается состояние, соответствующее фиктивному состоянию идеального газа.
Все эти величины приведены в таблицах и рассчитываются при наиболее стабильной модификации, и рассчитываются за счет того, что соединение состоит из простых веществ.
Дата добавления: 2015-08-14; просмотров: 1038;
