Равновесие органических реакций
В случае равновесной реакции:
A + B 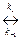 C + D
C + D
Свойства равновесия:
1. Динамичность, то есть, процесс во времени не останавливается, выравниваются лишь скорости прямой и обратной реакций.
2. Неизменность равновесного состава при постоянных внешних условиях.
3. Подвижность. То есть, самопроизвольное восстановление состояния равновесия после снятия внешнего воздействия, которое вызвало отклонение системы от состояния равновесия.
4. В момент равновесия 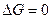 .
.
Для расчета количеств равновесного состава систем будем пользоваться законом действующих масс:
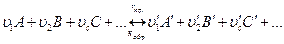
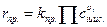
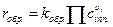
rпр. = rобр.
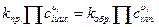
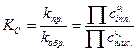
Если взяты не жидкости, а, например, газы, то константу равновесия находят как:
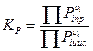
В случае если растворы обладают высокой ионной силой, вместо концентрации следует использовать активность.
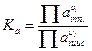
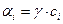
γ – коэффициент активности.
Коэффициент активности показывает отклонение от идеальности раствора.
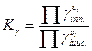
Закон Вант-Гоффа.
Связывает между собой термодинамические функции и константу равновесия:
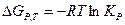
Для расчета энтальпии и энтропии, а также 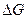 при различных температурах применяются законы Кирхгофа:
при различных температурах применяются законы Кирхгофа:
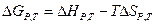
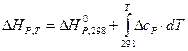
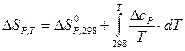
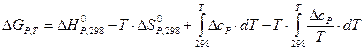
Эти уравнения можно решать напрямую, для этого обычно используется метод Темкина-Шварцмана:
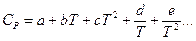 ,
,
где a, b, c – постоянные экспериментальные коэффициенты.
Но обычно ограничиваются тремя слагаемыми:
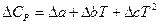
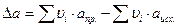
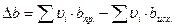
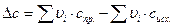
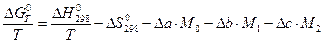 ,
,
где M0, M1, M2 – интегралы Темкина-Шварцмана. Определяются из таблиц, либо по формулам.
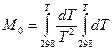
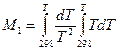
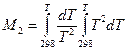
Дата добавления: 2015-08-14; просмотров: 1023;
