Изменения параметров связи между атомами C в зависимости от ее кратности
С увеличением кратности связи, как и следовало ожидать, уменьшается ее длина. Кратность связи увеличивается дискретно, т. е. в целое число раз, поэтому, если бы все связи были одинаковы, энергия также увеличилась бы в соответствующее число раз. Однако, как видно из табл. 1, энергия связи растет менее интенсивно, чем кратность. Следовательно, связи неравноценны. Это можно объяснить различием геометрических способов перекрывания орбиталей. Рассмотрим эти различия.
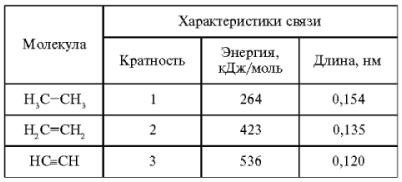
Связь, образованная перекрыванием электронных облаков по оси, проходящей через ядра атомов, называется σ-связью.
Если в связи участвует s-орбиталь, то может образоваться только σ-связь (рис. 5, а, б, в). Отсюда она и получила свое название, т. к. греческая буква σ является синонимом латинской s.
При участии в образовании связи р-орбитали (рис. 5, б, г, д) и d-орбитали (рис. 5, в, д, е) перекрывание по σ-типу осуществляется в направлении наибольшей плотности электронных облаков, которое и является наиболее энергетически выгодным. Поэтому при образовании связи такой способ всегда реализуется в первую очередь. Следовательно, если связь одинарная, то это обязательно σ-связь, если кратная, то одна из связей непременно σ-связь.
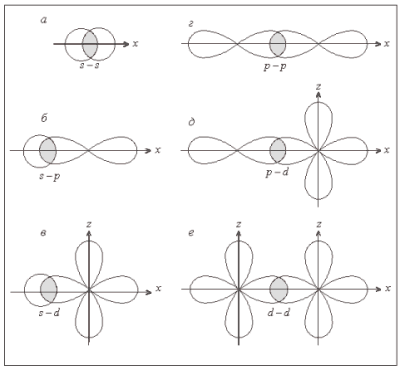
Рис. 5. Примеры σ-связей
Однако из геометрических соображений понятно, что между двумя атомами может быть только одна σ-связь. В кратных связях вторая и третья связи должны быть образованы другим геометрическим способом перекрывания электронных облаков.
Связь, образованная перекрыванием электронных облаков по обе стороны от оси, проходящей через ядра атомов, называется π-связью. Примеры π-связи приведены на рис. 6. Такое перекрывание энергетически менее выгодно, чем по σ-типу. Оно осуществляется периферийными частями электронных облаков с меньшей электронной плотностью. Увеличение кратности связи означает образование π-связей, которые имеют меньшую энергию по сравнению с σ-связью. В этом и есть причина нелинейного увеличения энергии связи в сравнении с увеличением кратности.
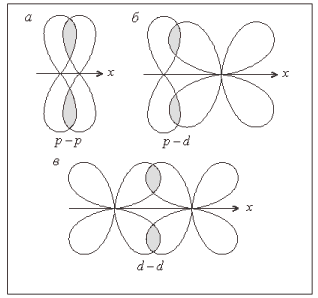
Рис. 6. Примеры π-связей
Рассмотрим образование связей в молекуле N2. Как известно, молекулярный азот химически весьма инертен. Причиной этого является образование очень прочной тройной связи :
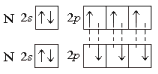
Схема перекрывания электронных облаков приведена на рис. 7. Одна из связей (2рх–2рх) образована по σ-типу. Две другие (2рz–2рz, 2рy–2рy) – по π-типу. Для того чтобы не загромождать рисунок, изображение перекрывания 2рy-облаков вынесено отдельно (рис. 7, б). Для получения общей картины рис. 7, а и 7, б следует совместить.
На первый взгляд может показаться, что σ-связь, ограничивая сближение атомов, не дает возможности перекрывания орбиталей по π-типу. Однако изображение орбитали включает лишь определенную долю (90%) электронного облака. Перекрывание происходит периферийной областью, находящейся вне такого изображения. Если представить орбитали, включающие большую долю электронного облака (например, 95%), то их перекрывание становится очевидным (см. штриховые линии на рис. 7, а).
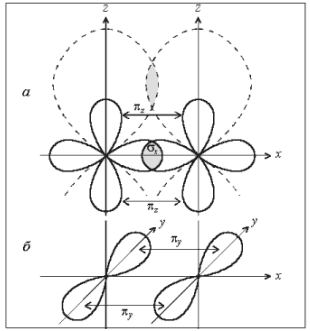
Рис. 7. Образование молекулы N2
Дата добавления: 2015-08-14; просмотров: 1287;
