Донорно-акцепторный механизм образования ковалентной связи
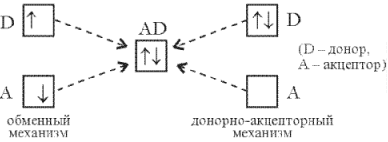
Пара электронов с антипараллельными спинами, образующая связь, может быть получена не только по обменному механизму, предусматривающему участие электронов обоих атомов, но и по иному механизму, называемому донорно-акцепторным: один атом (донор) предоставляет для образования связи неподеленную пару электронов, а другой (акцептор) – вакантную квантовую ячейку:
Результат по обоим механизмам получается одинаковый. Часто образование связи можно объяснить и тем, и другим механизмом. Например, молекулу НF можно получить не только в газовой фазе из атомов по обменному механизму, как показано выше (см. рис. 3), но и в водном растворе из ионов Н+ и F– по донорно-акцепторному механизму:
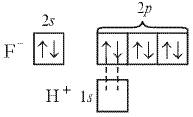
Вне сомнений, молекулы, полученные по разным механизмам, неразличимы; связи совершенно равноценны. Поэтому правильнее не выделять донорно-акцепторное взаимодействие в особый вид связи, а считать его лишь особым механизмом образования ковалентной связи.
Когда хотят подчеркнуть механизм образования связи именно по донорно-акцепторному механизму, ее обозначают в структурных формулах стрелкой от донора к акцептору (D®А). В других случаях такую связь не выделяют и обозначают черточкой, как и по обменному механизму: D–А.
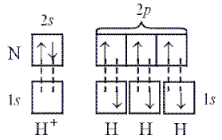
Связи в ионе аммония, образующегося по реакции: NH3 + H+ = NH4+,
выражаются следующей схемой:
Структурную формулу NН4+ можно представить как
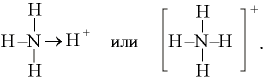 .
.
Вторая форма записи предпочтительней, поскольку отражает экспериментально установленную равноценность всех четырех связей.
Образование химической связи по донорно-акцепторному механизму расширяет валентные возможности атомов: валентность определяется не только числом неспаренных электронов, но и числом неподеленных электронных пар и вакантных квантовых ячеек, участвующих в образовании связей. Так, в приведенном примере валентность азота равна четырем.
Донорно-акцепторный механизм успешно используется для описания связи в комплексных соединениях по методу ВС.
Кратность связи. σ- и π-связи
Связь между двумя атомами может осуществляться не только одной, но и несколькими электронными парами. Именно числом этих электронных пар и определяется в методе ВС кратность – одно из свойств ковалентной связи. Например, в молекуле этана С2Н6 связь между атомами углерода одинарная (однократная), в молекуле этилена С2Н4 – двойная, а в молекуле ацетилена С2Н2 – тройная. Некоторые характеристики этих молекул приведены в табл. 1.
Таблица 1
Дата добавления: 2015-08-14; просмотров: 1649;
