Обменный механизм образования ковалентной связи по методу ВС. Направленность и насыщаемость ковалентной связи
Одним из важнейших понятий метода ВС является валентность. Численное значение валентности в методе ВС определяется числом связей, которые атом образует с другими атомами.
Рассмотренный для молекулы Н2 механизм образования связи парой электронов с антипараллельными спинами, принадлежавших до образования связи разным атомам, называется обменным. Если учитывать только обменный механизм, валентность атома определяется числом его неспаренных электронов.
Для молекул более сложных, чем Н2, принципы расчета остаются неизменными. К образованию связи приводит взаимодействие пары электронов с противоположными спинами. Результатом этого является увеличение электронной плотности в области перекрывания электронных облаков и стягивание ядер. Рассмотрим примеры.
В молекуле фтора F2 связь образована 2р-орбиталями атомов фтора:
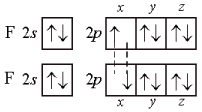
Наибольшая плотность электронного облака у 2р-орбитали в направлении оси симметрии. Если неспаренные электроны атомов фтора находятся на 2рх-орбиталях, связь осуществляется в направлении оси х (рис. 2). На 2рy- и 2рz-орбиталях находятся неподеленные электронные пары, не участвующие в образовании связей (на рис. 2 заштрихованы). В дальнейшем такие орбитали изображать не будем.
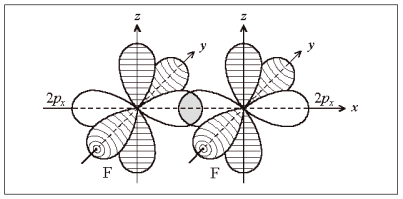
Рис. 2. Образование молекулы F2
В молекуле фтороводорода НF связь образована 1s-орбиталью атома водорода и 2рх-орбиталью атома фтора:
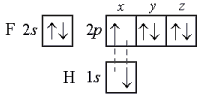
Направленность связи в этой молекуле определяется ориентацией 2рх-орбитали атома фтора (рис. 3). Перекрывание происходит в направлении оси симметрии х. Любой другой вариант перекрывания энергетически менее выгоден.
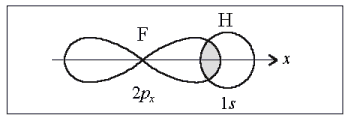
Рис. 3. Образование молекулы НF
Более сложные d- и f-орбитали также характеризуются направлениями максимальной электронной плотности вдоль осей их симметрии.
Таким образом, направленность – одно из основных свойств ковалентной связи.
Направленность связи хорошо иллюстрирует пример молекулы сероводорода Н2S:
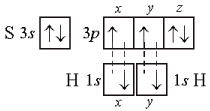
Поскольку оси симметрии валентных 3р-орбиталей атома серы взаимно перпендикулярны, то следует ожидать, что молекула Н2S должна иметь уголковую структуру с углом между связями S–Н 90° (рис. 4). Действительно, угол близок к расчетному и равен 92°.
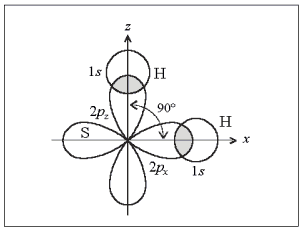
Рис. 4. Образование молекулы Н2S
Очевидно, что число ковалентных связей не может превышать числа образующих связи электронных пар. Однако насыщаемость как свойство ковалентной связи означает также, что если атом имеет некоторое количество неспаренных электронов, то все они должны участвовать в образовании ковалентных связей.
Это свойство объясняется принципом наименьшей энергии. При образовании каждой дополнительной связи выделяется дополнительная энергия. Поэтому все валентные возможности реализуются полностью.
Действительно, устойчива молекула Н2S, а не НS•, где имеется нереализованная связь (неспаренный электрон обозначают точкой). Частицы, содержащие неспаренные электроны, называют свободными радикалами. Они чрезвычайно реакционноспособны и вступают в реакции с образованием соединений, содержащих насыщенные связи.
Дата добавления: 2015-08-14; просмотров: 1094;
