Термодинамические процессы идеальных газов.
К основным процессам, имеющим большое значение, как для теоретических исследований, так и для практических работ в технике, относятся: изохорный, протекающий при постоянном объеме; изобарный, протекающий при постоянном давлении; изотермический,, протекающий при постоянной температуре; адиабатный, протекающий при отсутствии теплообмена с внешней средой.
Кроме того, существует группа процессов, являющихся при определенных условиях обобщающими для основных процессов. Эти процессы называются политропными и характеризуются постоянством теплоемкости в процесса.
Для всех процессов устанавливается общий метод исследований, который заключается в следующем;
выводится уравнение кривой процесса на 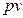 - и
- и  -диаграммах;
-диаграммах;
устанавливается зависимость между основными параметрами рабочего тела в начале и конце процесса;
определяется изменение внутренней энергии по формуле, справедливой для всех процессов идеального газа:
 ,
,
или при постоянной теплоемкости:
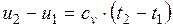 ;
;
вычисляется работа изменения объема газа по основной формуле:
 ;
;
определяется удельное количество теплоты, участвующее в процессе, по формуле:
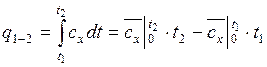 ;
;
определяется изменение удельной энтальпии в процессе по формуле, справедливой для всех процессов идеального газа:
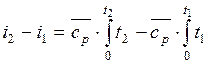
или для постоянной теплоемкости:
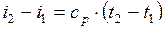 ;
;
определяется изменение удельной энтропии идеального газа по формулам:
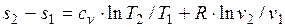 ,
,
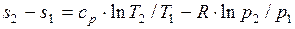 .
.
Рассматриваемые процессы считаются обратимыми.
Изохорный процесс
Процесс, протекающий при постоянном объеме, называют изохорным ( 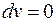 , или
, или 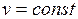 ). Кривая процесса называется изохорой.
). Кривая процесса называется изохорой.
При постоянном объеме давление газа изменяется прямо пропорционально абсолютным температурам:
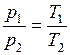 . (1.17.1)
. (1.17.1)
Внешняя работа газа при 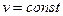 равна нулю, так как
равна нулю, так как 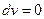 . Следовательно,
. Следовательно,
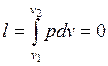 .
.
Удельная располагаемая (полезная) внешняя работа 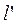 , которая может быть передана внешнему объекту работы, равна:
, которая может быть передана внешнему объекту работы, равна:
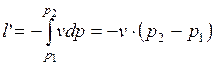 .
.
Если процесс 1-2 осуществляется с увеличением давления, то удельное количество теплоты в нем подводится, при этом увеличиваются внутренняя энергия и температура газа. Если давление в процессе понижается, то удельное количество теплоты отводится, уменьшаются внутренняя энергия и температура газа.
Изменение удельной энтропии в обратимом изохорном процессе определяем из уравнения:
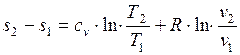 ,
,
Изменение энтропии при постоянной теплоемкости равно
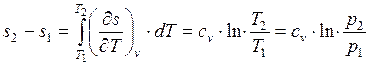 . (1.17.2)
. (1.17.2)
Как видно из данного уравнения, изохора на  – диаграмме представляет собой кривую 1-2 (рис. 1.17.1). Подкасательная к кривой 1–2 в любой ее точке дает значение истинной теплоемкости
– диаграмме представляет собой кривую 1-2 (рис. 1.17.1). Подкасательная к кривой 1–2 в любой ее точке дает значение истинной теплоемкости  .
.
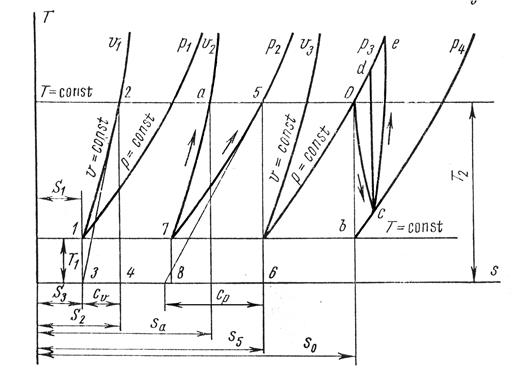
Рис. 1.17.1
Изобарный процесс
Процесс, протекающий при постоянном давлении, называют изобарным ( 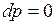 , или
, или 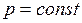 ). Кривая процесса называется изобарой.
). Кривая процесса называется изобарой.
Это соотношение называется законом Гей-Люссака. Для процесса 1-2
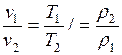 . (1.17.3)
. (1.17.3)
В изобарном процессе объемы одного и того же количества газа изменяются прямо пропорционально абсолютным температурам.
При расширении газа его температура возрастает, при сжатии – уменьшается.
Удельная работа изменения объема при этом выражается следующим уравнением:
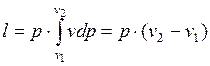 , (1.17.4)
, (1.17.4)
или
 . (1.17.5)
. (1.17.5)
Для обратимого изобарного процесса при постоянной теплоемкости изменение удельной энтропии находится по уравнению:
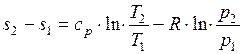 ,
,
Но при 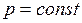
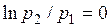 , поэтому
, поэтому
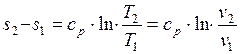 . (1.17.6)
. (1.17.6)
В случае изохорного и изобарного процессов в одном интервале температур возрастание энтропии будет больше в изобарном процессе, так как 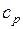 всегда больше
всегда больше 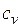 .
.
Изотермный процесс
Процесс, протекающий при постоянной температуре, называют изотермическим (  , или
, или 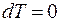 ). Кривая процесса называется изотермой (рис. 18.2).
). Кривая процесса называется изотермой (рис. 18.2).
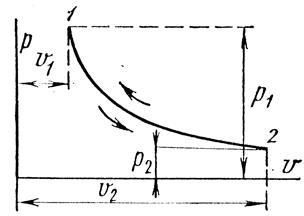
Рис. 1.17.2
 и
и 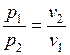 (1.17.7)
(1.17.7)
При постоянной температуре объем газа изменяется обратно пропорционально его давлению (закон Бойля – Мариотта).
На 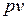 – диаграмме изотермный процесс представляет собой равнобокую гиперболу.
– диаграмме изотермный процесс представляет собой равнобокую гиперболу.
Зная уравнение изотермного процесса для идеального газа, можно подсчитать работу процесса.
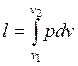
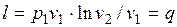 . (1.17.8)
. (1.17.8)
Удельная располагаемая внешняя работа 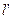 определяется по формуле:
определяется по формуле:
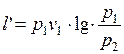 , (1.17.9)
, (1.17.9)
т. е. в изотермном процессе идеального газа 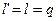 , или удельная работа изменения объема, располагаемая (полезная) работа и удельное количество теплоты, полученное телом, равны между собой.
, или удельная работа изменения объема, располагаемая (полезная) работа и удельное количество теплоты, полученное телом, равны между собой.

откуда
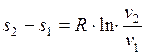 и
и 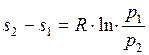 (1.17.10)
(1.17.10)
Удельное количество теплоты, участвующее в изотермическом процессе, равно произведению изменения удельной энтропии 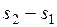 на абсолютную температуру
на абсолютную температуру 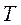 :
:
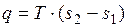
Адиабатный процесс
Процесс, протекающий без подвода и отвода теплоты, т. е. при отсутствии теплообмена рабочего тела с окружающей средой, называют адиабатным.
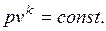 (1.17.11)
(1.17.11)
При адиабатном процессе произведение давления на объем газа в степени 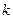 есть величина постоянная. Величину
есть величина постоянная. Величину 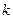 называют показателем адиабаты. Рассмотрим зависимость между основными параметрами в адиабатном процессе.
называют показателем адиабаты. Рассмотрим зависимость между основными параметрами в адиабатном процессе.
Из уравнения адиабаты следует, что
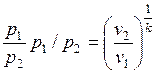 и
и 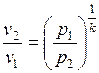
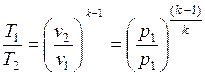 .
.
Удельная работа изменения объема 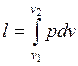 , совершаемая телом над окружающей средой при равновесном адиабатном процессе, может быть вычислена по уравнению адиабаты
, совершаемая телом над окружающей средой при равновесном адиабатном процессе, может быть вычислена по уравнению адиабаты
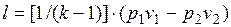 . (1.17.12)
. (1.17.12)
Из выражения (18.12) могут быть получены следующие формулы:
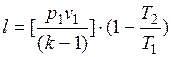 и
и 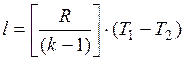 .
.
Вычислим располагаемую (полезную) внешнюю работу в адиабатном процессе, равную:
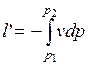 .
.
Следовательно,
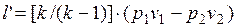 (1.17.13)
(1.17.13)
И 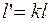 .
.
Политропные процессы
Условились всякий процесс идеального газа, в котором теплоемкость является постоянной величиной, называть политропным процессом, а линию процесса – политропой.
Они протекают при постоянной теплоемкости.
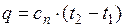 (1.17.14)
(1.17.14)
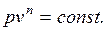 (1.17.15)
(1.17.15)
Показатель политропы 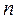 принимает для каждого процесса определенное числовое значение. Для основных процессов: изохорных
принимает для каждого процесса определенное числовое значение. Для основных процессов: изохорных 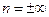 , изобарных
, изобарных 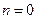 , изотермических
, изотермических 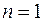 и адиабатных
и адиабатных 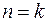 .
.
Поскольку уравнение политропы отличается от уравнения адиабаты только величиной показателя 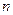 , то, очевидно, все соотношения между основными параметрами могут быть представлены формулами, аналогичными адиабатному процессу:
, то, очевидно, все соотношения между основными параметрами могут быть представлены формулами, аналогичными адиабатному процессу:
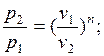

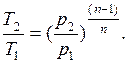
Уравнение удельной работы изменения объема, совершаемой телом при политропном процессе, имеет аналогичный вид с уравнением работы в адиабатном процессе, т. е.
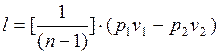 (1.17.16)
(1.17.16)
Для конечного изменения состояния
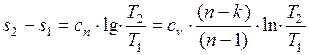 . (1.17.17)
. (1.17.17)
Дата добавления: 2015-08-11; просмотров: 2693;
