Окислительно-восстановительные потенциалы.
Окислительно-восстановительные реакции сопровождаются изменением заряда или степени окисления взаимодействующих в растворе ионов.
Работа гальванического элемента основана на протекании реакций окисления-восстановления.
Пример: медно-цинковый элемент
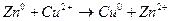

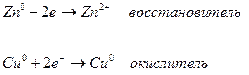
В гальваническом элементе реакция протекает на границе раздела фаз: электрода и раствора соответствующей соли металла.
Если вместо активных электродов использовать инертные, то можно определить относительную величину окислительно-восстановительного потенциала.
Абсолютную величину окислительно-восстановительного потенциала определить невозможно, поэтому его измеряют относительно стандартного, чаще всего водородного, нормальный потенциал которого принят равным 0 в реакции
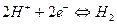 .
.
Существуют таблицы нормативных окислительно-восстановительных потенциалов, которые определены при концентрации их солевых растворов с концентрацией 1 моль/л и при t=200С.
Пользуясь нормальными окислительно-восстановительными потенциалами можно определить вещество в реакции будет окислителем или восстановителем, в каком направлении пойдет реакция, рассчитать окислительно-восстановительный потенциал данного процесса.
Пример:
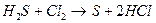
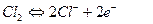 Е0=1,36 В – окислитель
Е0=1,36 В – окислитель
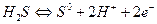 Е0=0,14 В
Е0=0,14 В
Еh= 1,36 – 0,14 = 1,22 В
Еh> 0 – самопроизвольное протекание реакции.
Зависимость величины окислительно-восстановительного потенциала от концентрации окисленной и восстановленной формы в растворе описывается формулой Нернста:
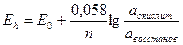
а – активность соединения в окисленной и восстановленной форме;
n – число электронов, отданных инертному электроду, при протекании окислительно-восстановительной реакции.
Для тех реакций, где одним из компонентов является вода или ионы Н+ окислительная способность зависит от рН
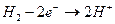

n = 2
Е0 = 0 для водородного электрода
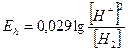
Обозначим - lg [H2] = rH2
lg [H2] – отрицательный логарифм давления молекулярного водорода, тогда
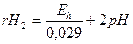
Уравнение позволяет охарактеризовать окислительно-восстановительные свойства среды: чем меньше rH2, тем легче идут процессы восстановления.
Нейтральным пунктом относительно окислительно-восстановительных условий для водных растворов принимается rH2 = 28, при rH2 > 28 – в водоеме окисление, при rH2 < 28 – восстановление.
Еh = f ([Н2], [Н+]) – характеристика свободной энергии окислительно-восстановительной системы.
С помощью Еh можно охарактеризовать окислительно-восстановительные условия системы только при рН = const.
rH2 – зависит только от концентрации восстановителя, поэтому rH2 полностью характеризует окислительно-восстановительные условия.
Дата добавления: 2015-08-11; просмотров: 1368;
