Метод электронного баланса

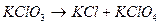 - разложение хлора калия
- разложение хлора калия
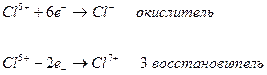
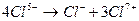
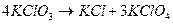 реакция диспропорционирования
реакция диспропорционирования
Окислительно-восстановительные реакции подразделяются на три группы:
1. Межатомные или межмолекулярные окислительно-восстановительные. Обмен электронами происходит между различными по составу частицами.
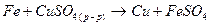

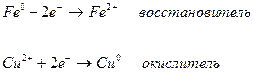

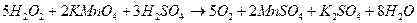
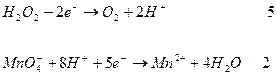

2. Реакции самоокисления-самовосстановления (диспропорционирования). В этом случае молекулы или атомы одного и того же вещества реагируют друг с другом как восстановитель и окислитель, т.к. имеющийся в них атом с промежуточной степенью окисления способен отдавать и принимать электроны.
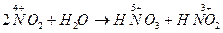
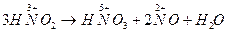
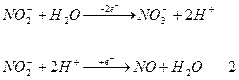
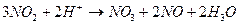
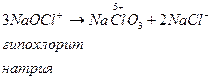
3. Внутримолекулярное окисление-восстановление.
Два разных атома в молекуле могут быть по отношению друг к другу окислителем и восстановителем.
Например, 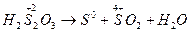
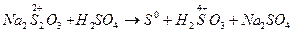

 О
О

Н
В окислительно-восстановительных реакциях окислитель и восстановитель взаимодействуют в эквивалентных количествах.
Эквивалентом окислителя или восстановителя называется некоторая реальная или условная частица, которая может присоединять или отдавать один электрон в окислительно-восстановительной реакции.
Например для реакции (1) эквивалент перманганата калия и KNO2 определяется как частное от деления молекулярного веса на число отданных электронов нитрита калия.
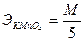 5 – число электронов участвующих в реакции
5 – число электронов участвующих в реакции
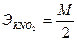 2 - число электронов участвующих в реакции
2 - число электронов участвующих в реакции
На законе эквивалентов основано количественное определение концентрации окислителей и восстановителей методом титрования.
Дата добавления: 2015-08-11; просмотров: 694;
