Лекция 14. Окислительно-восстановительные процессы
Окислительно-восстановительные реакции. Понятие об электродных потенциалах. Гальванические элементы, ЭДС и ее измерение. Стандартный водородный электрод и водородная шкала потенциалов. Уравнение Нернста. Потенциалы металлических, газовых и окислительно-восстановительных электродов. Концентрационные и топливные гальванические элементы.
- 14.1. Окислительно-восстановительные реакции Окислительно-восстановительными называются реакции, которые сопровождаются изменением степени окисления атомов, входящих в состав реагирующих веществ. Атом элемента в высшей степени окисления является только окислителем (например, сера в молекуле H2SO4 имеет высшую степень окисления 6+); атом элемента в низшей степени окисления является только восстановителем (например, сера в молекуле H2S имеет низшую степень окисления 2-); атом элемента находящийся в промежуточной степени окисления может быть и окислителем и восстановителем (например, сера в молекуле H2SO3 имеет промежуточную степень окисления 4-). Такие соединения проявляют окислительно-восстановительную двойственность и способны к реакциям диспропорционирования.
Пример 1. Завершить уравнение реакции, дописав недостающие продукты. Составить уравнения полуреакций окисления и восстановления, на их основе написать уравнения реакций в ионной и молекулярной формах:
KNO2+KI+H2SO4®J2+NO + …`
Решение.В реакции иод меняет степень окисления от -1 в иодиде калия до нуля в I2. Иод теряет электроны, т.е. окисляется. Восстанавливаться в данной реакции будет азот, который меняет степень окисления от +3 до +2. Нитрит–ион восстанавливается до NO с приобретением одного электрона на каждый атом азота. Избыточный кислород нитрит-иона будет связываться водородными ионами кислой среды с образованием воды:


|
Полученное уравнение является уравнением искомой реакции в ионной форме. Молекулярное уравнение реакции получится , если учесть, что ионы калия, освобождающиеся при разрушении молекул KNO2 и KJ образуют соли с серной кислотой: 2KNO2+2KI+2H2SO4®J2+2NO +2 К2SO4+2 H2O.
 14.2.Понятие об электродных потенциалах. Общие свойства металлов: электропроводность, теплопроводность, пластичность,- обусловлены типом химической связи в металлах, которая так и называется металлическая связь. Суть металлической связи заключается в том, что часть атомов в металле теряет свои валентные электроны, превращаясь в ионы.
14.2.Понятие об электродных потенциалах. Общие свойства металлов: электропроводность, теплопроводность, пластичность,- обусловлены типом химической связи в металлах, которая так и называется металлическая связь. Суть металлической связи заключается в том, что часть атомов в металле теряет свои валентные электроны, превращаясь в ионы.
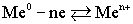
Таким образом, в узлах кристаллической решетки любого металла располагаются как нейтральные атомы, так и положительные ионы. Потерянные электроны располагаются в междоузлиях, образуя так называемый коллективный электронный газ.Ионы металла, располагающиеся на его границе, гидратируются молекулами воды:. 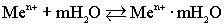 ,Под влиянием всевозможных видов движения гидратированные ионы отрываются от металла и уходят в воду:
,Под влиянием всевозможных видов движения гидратированные ионы отрываются от металла и уходят в воду: 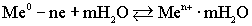 .На границе металла и воды возникает двойной электрический слой, т.е. скачок потенциала Up,В, который называется равновесным электродным потенциалом. Знак потенциала определяется по заряду металла. Количество ионов металла, содержащихся в литре насыщенного раствора, называется растворимостью металла. По величине растворимости металлы подразделяются на:активные и пассивныe.
.На границе металла и воды возникает двойной электрический слой, т.е. скачок потенциала Up,В, который называется равновесным электродным потенциалом. Знак потенциала определяется по заряду металла. Количество ионов металла, содержащихся в литре насыщенного раствора, называется растворимостью металла. По величине растворимости металлы подразделяются на:активные и пассивныe.
Дата добавления: 2015-08-08; просмотров: 1206;
