Лекция 16. Коррозия металлов.
Основные виды коррозии. Классификация коррозионный процессов. Химическая и электрохимическая коррозии. Газовая, атмосферная, почвенная коррозия, коррозия под действием блуждающих токов. Коррозия в электролитах, в не электролитах, биохимическая коррозия. Окислительно-восстановительные процессы, протекающие при различных видах коррозии. Методы защиты от коррозии. Анодные и катодные покрытия. Протекторная и электрозащита. Ингибиторы коррозии.
1.Основные виды коррозии.Коррозия металлов – разрушение металлов под действием агрессивной окружающей среды.Виды коррозии: плошная; участками; питтинг; межзерновая; растрескивание; селективная. Все виды коррозии одинаково опасны. По механизмам протекания процесса коррозия подразделяется на химическую и электрохимическую.Химическая коррозия:газовая; жидкостная. Газовая коррозия происходит под влиянием агрессивных сухих газов.
Жидкостная коррозия вызывается растворами неэлектролитов. Этот вид коррозии очень характерен для продуктов нефтехимии.
Электрохимическая коррозия отличается от химической коррозии тем, что в системе возникает направленный поток электронов, т.е. электрохимическая коррозия возникает там, где присутствуют электролиты. Электрохимическая коррозия:гальванокоррозия (аналогична работе гальванического элемента); электрокоррозия (представляет собой электролиз). Электрохимическая коррозия гораздо активнее химической коррозии. Гальванокоррозия вызывается многими причинами.
Основная причина возникновения гальванокоррозии - тесный контакт двух металлов с различными потенциалами, находящихся в среде электролита.
Металлы, находящиеся в тесном контакте (спай), образуют короткозамкнутый гальванический элемент.
Например, спай алюминия с медью.По соотношению потенциалов алюминий является анодом, медь – катодом. Рассмотрим данную гальванопару в кислой среде: 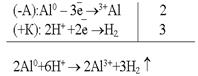 Разрушается анод, в данном случае алюминий.Второй причиной возникновения гальванокоррозии является неоднородность металлов. Больше всего это относится к техническому железу – чугунам и сталям.
Разрушается анод, в данном случае алюминий.Второй причиной возникновения гальванокоррозии является неоднородность металлов. Больше всего это относится к техническому железу – чугунам и сталям.
Техническое железо состоит в основном из кристаллов железа и участков цементита. 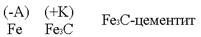 Кристаллы железа играют роль микроанодов, участки цементита – микрокатодов.
Кристаллы железа играют роль микроанодов, участки цементита – микрокатодов.
Рассмотрим данную систему в окружающей среде: воздухе с содержащейся в нём влагой (О2+2Н2О). 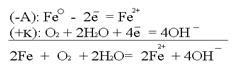 Следующей распространённой причиной возникновения гальванокоррозии является аэрация – неравномерный доступ кислорода (или воздуха) к разным участкам одного и того же металла.Примером может служить вбитый во влажное дерево гвоздь. Та часть изделия (гвоздя), к которой доступ воздуха свободен, является катодом. Часть гвоздя, находящаяся в дереве, является анодом. Возникает коррозия:
Следующей распространённой причиной возникновения гальванокоррозии является аэрация – неравномерный доступ кислорода (или воздуха) к разным участкам одного и того же металла.Примером может служить вбитый во влажное дерево гвоздь. Та часть изделия (гвоздя), к которой доступ воздуха свободен, является катодом. Часть гвоздя, находящаяся в дереве, является анодом. Возникает коррозия: 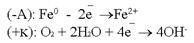 Электрокоррозия – это коррозия материалов под влиянием электрического тока от внешнего источника (коррозия блуждающих токов).
Электрокоррозия – это коррозия материалов под влиянием электрического тока от внешнего источника (коррозия блуждающих токов).
Источниками блуждающих токов являются: весь электротранспорт, электроаппараты, работающие на земле. Поток электронов, идущий по рельсу, встречая какое -– либо омическое сопротивление, например стык, уходит в почву. Этот участок рельса становился катодом по отношению к близко расположенному участку трубопровода. Почва по своему составу является прекрасным проводником электронов. В почве такой поток электронов может пройти десятки километров. На своём пути поток электронов встречает какой-либо металлический предмет, например, трубопровод, и входит в него. Данный участок трубопровода становится анодом и начинает разрушаться: 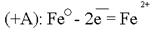 Ионы Fe уходят в землю, а поток электронов направляется далее по трубопроводу до тех пор, пока не встретит какое-либо новое сопротивление. Встретив сопротивление, электроны уходят в землю, превращая данный участок трубопровода в катод. Поток электронов может войти в тот же рельс, откуда он вышел, превращая его в анод. Катодный процесс зависит от состава почвы.
Ионы Fe уходят в землю, а поток электронов направляется далее по трубопроводу до тех пор, пока не встретит какое-либо новое сопротивление. Встретив сопротивление, электроны уходят в землю, превращая данный участок трубопровода в катод. Поток электронов может войти в тот же рельс, откуда он вышел, превращая его в анод. Катодный процесс зависит от состава почвы. 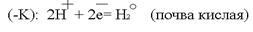 или
или 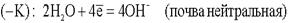 .
.
2.Защита металлов от коррозииВ результате коррозии металлические изделия разрушаются, причем в таком количестве, что борьба с коррозией необходима.
Способов борьбы с коррозией очень много. Основные способы: электрозащита; защитные покрытия, которые подразделяются на металлические и неметаллические; легирование.
Электрозащита К электрозащите относятся способы, при которых в системе возникает направленный поток электронов: катодная защита, протекторная защита.
Катодная защита. Суть её сводится к следующему: к катоду внешнего источника питания присоединяют защищаемый металл, к аноду – ненужный кусок металла. Пока поступает ток от внешнего источника, анод разрушается, а катод остается в целости и сохранности. Недостатком этого метода является расход электроэнергии.
Протекторная защита. Суть ее: два металла - защищаемый и протектор - приводятся в тесный контакт. Металл протектора подбирается так, чтобы он оказался анодом по отношению к защищаемому изделию. В первую очередь разрушается анод, защищаемое изделие сохраняется.
Данный вид защиты относится к электрозащите, так как в системе возникает направленный поток электронов.
Электрозащита применяется в тех случаях, когда объём окружающей агрессивной среды очень велик. Электрозащита применяется на морских судах (подводные части), для защиты всех подводных и подземных сооружений. Защитные металлические покрытия В качестве первых защитных металлических покрытий использовались цинк и олово.Покрытие цинком – цинкование. Покрытие оловом – лужение. По соотношению потенциалов защищаемого металла и покрытия все защитные покрытия делятся на:катодные покрытия; анодные покрытия. 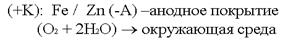 В случае нарушения защитного покрытия в первую очередь начнёт разрушаться само покрытие:
В случае нарушения защитного покрытия в первую очередь начнёт разрушаться само покрытие: 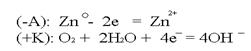 Анодные покрытия выгоднее тем, что начинает разрушаться само покрытие, т.е. есть возможность восстановить его, прежде чем начнет разрушаться основное изделие.
Анодные покрытия выгоднее тем, что начинает разрушаться само покрытие, т.е. есть возможность восстановить его, прежде чем начнет разрушаться основное изделие.
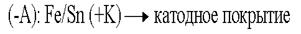
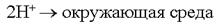 При разрушении покрытия будет разрушаться защищаемый металл.
При разрушении покрытия будет разрушаться защищаемый металл. 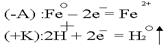
В настоящее время металлические покрытия широко применяются, и назначения этих покрытий весьма различны. Кроме защитной функции, они могут выполнять декоративную функцию, а также весьма различные технологические назначения. Поэтому покрытия наносятся без учета того, анодными или катодными они являются.Защитные неметаллические покрытия.Сюда относятся краски, лаки, эмали, полимеры. Также сюда относятся фосфотирование и оксидирование (воронение) стали. Оксидирование стали. На стали получают оксидную пленку сложного состава 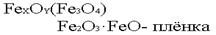
Эта пленка интенсивно черного цвета, отсюда и название – воронение. Структура пленки - плотная, беспористая, сцепление её с металлом очень прочное. При толщине пленки в 30-40  она надежно защищает изделия от коррозии.
она надежно защищает изделия от коррозии.
Фосфотирование производят из смеси, например, ZnHPO4 + фосфорная кислота
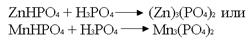 .Эти фосфатные пленки имеют хорошее прочное сцепление с техническим железом (сталь, чугун). Но поскольку пленки пористые, сами по себе они изделия от коррозии не защищают. В этом случае применяется дополнительная защита – краска. В соединении с краской защита очень надежна.
.Эти фосфатные пленки имеют хорошее прочное сцепление с техническим железом (сталь, чугун). Но поскольку пленки пористые, сами по себе они изделия от коррозии не защищают. В этом случае применяется дополнительная защита – краска. В соединении с краской защита очень надежна.
На практике, как правило, применяется не один вид защиты, а как минимум два.
Дата добавления: 2015-08-08; просмотров: 3048;
