Упражнения для самоконтроля направлены на закрепление знаний в области расстановки коэффициентов в уравнениях ОВР, электродных потенциалов, гальванических элементов.
1. Коэффициент перед молекулой восстановителя в уравнении реакции
КМnО4+NаNО2+Н2SО4=МnSО4+К2SО4+NаNО3+Н2О равен: а) 1, б) 3; в)5, г)7.
2. Используя ряд активности металлов, определите в какой паре металлов можно получить наибольшее значение ЭДС в гальваническом элементе?
а) Mn - Sn, б) Mn - Ag; в) Mn - Fe, г) Mn - Au.
3. При окислении происходит:
ٱ взаимодействие с кислородом
ٱ перемещение электронной пары
ٱ отдача электронов атомом, молекулой или ионом
ٱ присоединение электронов
Лекция 15. Электролиз.
Понятие электролиза. Виды электролиза. Последовательность электродных процессов. Выход по току. Электролиз с нерастворимыми и растворимыми анодами. Законы Фарадея. Поляризация при электролизе. Перенапряжение электрода.
15.1.Понятие электролиза. Виды электролиза.Электролизом называется процесс раздельного окисления и восстановления на электродах, опущенных в раствор или расплав электролита, осуществляемый за счет протекания тока от внешнего источника ЭДС. Электролиз – это процесс, обратный процессу, происходящему при работе гальванических элементов. Электролизом называется превращение электрической энергии в химическую. Существует три вида электролиза:
1. Электролиз расплава
Электроды в данном случае выполнены из пассивных материалов (платина, графит)
 .На катоде всегда происходит восстановление, на аноде – окисление:
.На катоде всегда происходит восстановление, на аноде – окисление: 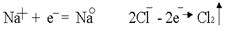 .
.
 2. Электролиз водного раствора электролита с пассивными электродами
2. Электролиз водного раствора электролита с пассивными электродами
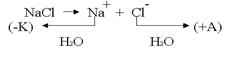 .К катоду подходят ионы натрия и молекулы воды.Чтобы выбрать, какое вещество будет восстанавливаться на катоде в первую очередь, надо сравнить потенциалы данных веществ
.К катоду подходят ионы натрия и молекулы воды.Чтобы выбрать, какое вещество будет восстанавливаться на катоде в первую очередь, надо сравнить потенциалы данных веществ 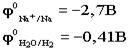 .По соотношению потенциалов этих двух веществ вода является более сильным окислителем и восстанавливается в первую очередь.
.По соотношению потенциалов этих двух веществ вода является более сильным окислителем и восстанавливается в первую очередь.
Катодное восстановление воды: 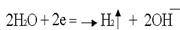 .
.
Чтобы выбрать, какое из веществ будет преимущественно окисляться на аноде, надо также сравнить их потенциалы 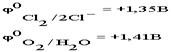 . По соотношению потенциалов видно, что ионы хлора являются более сильными восстановителями и, следовательно, будут окисляться в первую очередь.
. По соотношению потенциалов видно, что ионы хлора являются более сильными восстановителями и, следовательно, будут окисляться в первую очередь.
Анодное окисление хлора: 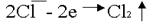 .
.
3. Электролиз раствора с активным анодом. Cu – активный анод, в качестве электролита – водный раствор H2SO4
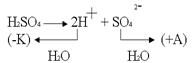 .По соотношению потенциалов в первую очередь будут восстанавливаться ионы водорода из кислоты
.По соотношению потенциалов в первую очередь будут восстанавливаться ионы водорода из кислоты
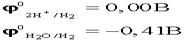 . . 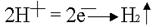 .На аноде могут окисляться три вещества: анионы электролита, молекулы воды и сам активный анод. .На аноде могут окисляться три вещества: анионы электролита, молекулы воды и сам активный анод. 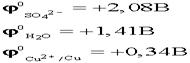 .По соотношению потенциалов активный анод будет окисляться в первую очередь: .По соотношению потенциалов активный анод будет окисляться в первую очередь: 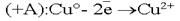 . В силу диффузии ионы меди из анодного пространства, где их концентрация высока, будут перемещаться к катоду. Когда . В силу диффузии ионы меди из анодного пространства, где их концентрация высока, будут перемещаться к катоду. Когда 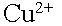 достигнет катода, то по соотношению потенциалов меди и водорода, начнется восстановление ионов меди: достигнет катода, то по соотношению потенциалов меди и водорода, начнется восстановление ионов меди: 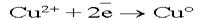 . .
| |
15.2.Законы Фарадея . Законы Фарадея являются количественными законами электролиза. Первый закон Фарадея: Масса вещества, выделяющегося на электродах, прямо пропорциональна количеству прошедшего через раствор электричества
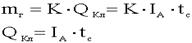 .Второй закон Фарадея:При прохождении через расплав или раствор электролита 96500 Кл электричества на электродах выделяется 1 моль эквивалента вещества. .Второй закон Фарадея:При прохождении через расплав или раствор электролита 96500 Кл электричества на электродах выделяется 1 моль эквивалента вещества.
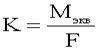 - электрохимический эквивалент вещества. - электрохимический эквивалент вещества. 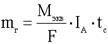 - объединённый закон Фарадея. - объединённый закон Фарадея.
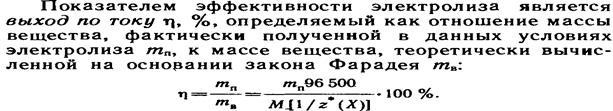 15.3.Поляризация при электролизе Поляризация при электролизе складывается из собственно поляризации, которая делится на химическую и концентрационную, и перенапряжения. Химическая поляризация возникает при использовании инертных электродов.
15.3.Поляризация при электролизе Поляризация при электролизе складывается из собственно поляризации, которая делится на химическую и концентрационную, и перенапряжения. Химическая поляризация возникает при использовании инертных электродов.
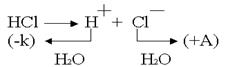 . . 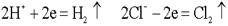 .Какими бы ни были инертные электроды (Pt, С, керамика), все они прекрасно адсорбируют газы. .Какими бы ни были инертные электроды (Pt, С, керамика), все они прекрасно адсорбируют газы. 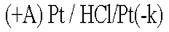 .Платина – анод насыщается хлором; платина – катод поглощает водород. Хлор может только восстанавливаться, водород - окисляться: .Платина – анод насыщается хлором; платина – катод поглощает водород. Хлор может только восстанавливаться, водород - окисляться: 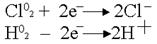 .В электролизере образуется гальванический элемент: .В электролизере образуется гальванический элемент:
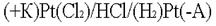 .Электродвижущая сила возникшего гальванического элемента направлена против внешнего напряжения и ослабляет его. Данный вид поляризации называется химическим по той причине, что электроды как бы меняют свою химическую природу. Поляризация играет отрицательную роль, так как она приводит к перерасходу электроэнергии. С химической поляризацией борются химическим путем. В раствор добавляют вещества, которые очищают электроды от поглощённых газов. Концентрационная поляризация происходит при активном аноде, например, серебряном .Электродвижущая сила возникшего гальванического элемента направлена против внешнего напряжения и ослабляет его. Данный вид поляризации называется химическим по той причине, что электроды как бы меняют свою химическую природу. Поляризация играет отрицательную роль, так как она приводит к перерасходу электроэнергии. С химической поляризацией борются химическим путем. В раствор добавляют вещества, которые очищают электроды от поглощённых газов. Концентрационная поляризация происходит при активном аноде, например, серебряном
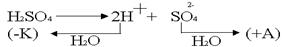  .
В силу диффузии ионы серебра от анода стремятся к катоду, где они начнут восстанавливаться как более сильные окислители. Поскольку диффузия в жидкостях медленная, концентрация ионов Ag в анодном пространстве намного выше, чем в катодном. Вследствие этого в электролизере возникает концентрационный гальванический элемент. ЭДС возникшего концентрационного элемента также направлена против внешнего напряжения и ослабляет его. С концентрационной поляризацией бороться гораздо проще, чем с химической. Ее устраняют перемешиванием раствора.
15.4.Перенапряжение электрода Перенапряжением электрода называют разность между фактическим и теоретическим электродными потенциалами. Перенапряжение металлов настолько мало, что им пренебрегают. Велико перенапряжение водорода и кислорода. Перенапряжение водорода велико при следующих условиях: малых плотностях тока, низких температурах раствора. Перенапряжение также зависит от материала катода. Перенапряжение водорода наиболее велико на тех металлах, которые в ряду напряжений располагаются вблизи водорода. Перенапряжение водорода может играть как отрицательную, так и положительную роль. Отрицательную роль оно играет при необходимости получить водород электролитическим путем. Положительна роль перенапряжения при необходимости получить с помощью электролиза какой - либо металл, находящийся в ряду напряжений до водорода. Можно создать условия (плотность тока, температура раствора, материал катода, посторонние ионы в растворе), при которых вследствие высокого перенапряжения водорода из раствора можно восстановить металлы, стоящие в ряду напряжения до водорода, (вплоть до алюминия). .
В силу диффузии ионы серебра от анода стремятся к катоду, где они начнут восстанавливаться как более сильные окислители. Поскольку диффузия в жидкостях медленная, концентрация ионов Ag в анодном пространстве намного выше, чем в катодном. Вследствие этого в электролизере возникает концентрационный гальванический элемент. ЭДС возникшего концентрационного элемента также направлена против внешнего напряжения и ослабляет его. С концентрационной поляризацией бороться гораздо проще, чем с химической. Ее устраняют перемешиванием раствора.
15.4.Перенапряжение электрода Перенапряжением электрода называют разность между фактическим и теоретическим электродными потенциалами. Перенапряжение металлов настолько мало, что им пренебрегают. Велико перенапряжение водорода и кислорода. Перенапряжение водорода велико при следующих условиях: малых плотностях тока, низких температурах раствора. Перенапряжение также зависит от материала катода. Перенапряжение водорода наиболее велико на тех металлах, которые в ряду напряжений располагаются вблизи водорода. Перенапряжение водорода может играть как отрицательную, так и положительную роль. Отрицательную роль оно играет при необходимости получить водород электролитическим путем. Положительна роль перенапряжения при необходимости получить с помощью электролиза какой - либо металл, находящийся в ряду напряжений до водорода. Можно создать условия (плотность тока, температура раствора, материал катода, посторонние ионы в растворе), при которых вследствие высокого перенапряжения водорода из раствора можно восстановить металлы, стоящие в ряду напряжения до водорода, (вплоть до алюминия).
|
Вопросы для самопроверки:
1. Что будет выделяться на катоде и аноде, если водный раствор сульфата меди (II) подвергнуть электролизу?
ٱ Cu и SO4 ٱ Cu и O2 ٱ H2 и O2 ٱ H2 и SO4
Дата добавления: 2015-08-08; просмотров: 1424;
