Электродные потенциалы активных и пассивных металлов
 Рис.1 Рис.1
| Рассмотрим систему, в которой металл помещён в солевой раствор, рис1. Например, цинк, помещённый в раствор сульфата цинка. |
К активным металлам относится те, мера растворимости которых больше концентрации солевых растворов, принятых в электрохимии.
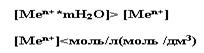 Если металл является активным, то равновесие обратимой реакции смещено в прямом направлении, т.е. в сторону окисления:
Если металл является активным, то равновесие обратимой реакции смещено в прямом направлении, т.е. в сторону окисления: 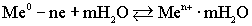 Возникающий электродный потенциал имеет знак "-".
Возникающий электродный потенциал имеет знак "-".
Пассивные металлы те, у которых величина растворимости меньше принятой в электрохимии концентрации солевых растворов. 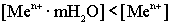 В данном случае равновесие реакции смещено в обратном направлении, т.е. в сторону восстановления. Возникающий электрический потенциал имеет знак "+".
В данном случае равновесие реакции смещено в обратном направлении, т.е. в сторону восстановления. Возникающий электрический потенциал имеет знак "+".
14.3.Величина равновесного электродного потенциала Нернст установил эту величину
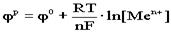 , где φ0 – стандартный электродный потенциал, т.е. потенциал, возникающий при нормальных условиях,
, где φ0 – стандартный электродный потенциал, т.е. потенциал, возникающий при нормальных условиях,
R - универсальная газовая постоянная,
Т - абсолютная температура, К,
F - число Фарадея, F = 96500 Кл,
n - число электронов, участвующих в реакции. Переходя от натурального логарифма к десятичному и подставляя в уравнение значение T=298K и соответствующие значения R и F, получаем выражение:
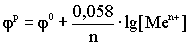
14.4.Устройство и работа гальванического элемента
Гальванический элемент - это устройство, состоящее из двух или более электродов, соединенных между собой.
ХИЭЭ – химический источник электроэнергии (гальванический элемент).В гальваническом элементе все время происходит нарушение равновесия данной реакции. 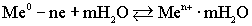 Гальванический элемент Якоби - Даниэля состоит из двух металлов с различными электродными потенциалами, например, меди и цинка. Электроды соединены между собой двояко. Металлические электроды соединены между собой металлическим проводником, а солевые растворы соединены либо полупроницаемой мембраной , либо электролитическим ключом . Электролитический ключ проводит анионы. Таким образом, в гальваническом элементе двоякая проводимость: электронная и ионная. Анодом является активный металл, катодом – пассивный.Чем меньше алгебраическая величина электродного потенциала, тем более активным является металл. В данном гальваническом элементе по соотношению потенциалов цинковый электрод является анодом, а медный - катодом. Анод окисляется:
Гальванический элемент Якоби - Даниэля состоит из двух металлов с различными электродными потенциалами, например, меди и цинка. Электроды соединены между собой двояко. Металлические электроды соединены между собой металлическим проводником, а солевые растворы соединены либо полупроницаемой мембраной , либо электролитическим ключом . Электролитический ключ проводит анионы. Таким образом, в гальваническом элементе двоякая проводимость: электронная и ионная. Анодом является активный металл, катодом – пассивный.Чем меньше алгебраическая величина электродного потенциала, тем более активным является металл. В данном гальваническом элементе по соотношению потенциалов цинковый электрод является анодом, а медный - катодом. Анод окисляется: 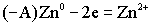 Освободившиеся электроны с анода переходят на катод, а ионы уходят в раствор. Ионы меди из солевого раствора подходят к металлу и здесь восстанавливаются:
Освободившиеся электроны с анода переходят на катод, а ионы уходят в раствор. Ионы меди из солевого раствора подходят к металлу и здесь восстанавливаются:  Избыток анионов из катодного солевого раствора в силу диффузии по электролитическому ключу переходит в катодный раствор, замыкая цепь.Во внутренней цепи гальванического элемента возникает электроток. Окислительно - восстановительная реакция
Избыток анионов из катодного солевого раствора в силу диффузии по электролитическому ключу переходит в катодный раствор, замыкая цепь.Во внутренней цепи гальванического элемента возникает электроток. Окислительно - восстановительная реакция 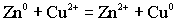
является причиной возникновения электротока. Кроме того, гальванический элемента обладает ЭДС, которая представляет собой разность между катодным и анодным потенциалами: 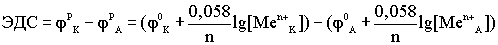
Электрохимическая схема гальванического элемента
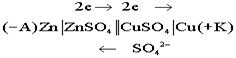
Недостатки элемента Якоби- Даниэля: малая Э Д С, разрушаемый анод.
Дата добавления: 2015-08-08; просмотров: 1447;
