II – коррозия с кислородной деполяризацией




 0,0
0,0
7 14 рН
Е(н+/н2) = - 0,059 · рН, В
 -1,2 I – коррозия с выделением Н2 и1
-1,2 I – коррозия с выделением Н2 и1
поглощением из электролита О2
Рис. 3. Диаграммы Пурбэ для водородного (1) и кислородного (2) электродов
Все металлы с потенциалами, более отрицательными, чем потенциал водородного электрода, термодинамически должны подвергаться коррозии. Часто этого не наблюдается из-за образования оксидных или солевых пленок на поверхности металла.
По этой причине, коррозия не всегда имеет деструктивный характер. Например, зеленый налет, наблюдаемый на бронзовых скульптурах, является малахитом, образующимся по реакции
Cu + O2 + CO2 + H2O = (CuOH)2CO3] и который защищает металл от атмосферной коррозии. Этим объясняется прекрасное состояние многих старинных бронзовых и медных скульптур и монет.
Из рис. 3 следует, что потенциалы кислородного электрода в зависимости от рН равны:
О2 + 4Н+ + 4е = 2Н2О ( рН=0) Е°= +1,23 В
О2 + 2Н2О + 4е = 4ОН- (рН=7) Е°= +0,81 В
О2 + 2Н2О + 4е = 4ОН- (рН=14) Е°= +0,41 В
Очевидно, в насыщенной кислородом кислой среде подвергаться коррозии с кислородной деполяризацией могут те металлы, стандартный электродный потенциал которых лежит
отрицательнее +1,23 В, в нейтральной - +0,81 В, а в щелочной - отрицательнее + 0,4 В.
Коррозии с водородной деполяризацией в кислой среде будут подвергаться металлы, стандартный электродный потенциал которых лежат отрицательнее +0,00 В (Fe, Ni, Zn, Cd, Al), в нейтральной - – 0,41 В, а в щелочной – отрицательнее - - 0,82 В.
Таким образом, все металлы, у которых равновесные потенциалы отрицательнее соответствующего для этих условий потенциала водородного или кислородного электродов, могут растворяться, а металлы, у которых равновесный потенциал положительнее этих потенциалов, не подвергаются коррозии.
Из приведенных данных видно, что более активными в коррозионном отношении являются среды, содержащие кислород, так как потенциал кислородного электрода больше потенциала водородного электрода на 1,23 В при любых значениях рН.
В нейтральной среде коррозия всегда протекает с кислородной деполяризацией. Этот вид коррозии наиболее широко распространен
в природе: он наблюдается при коррозии металлов в воде, почве и в атмосфере. С кислородной деполяризацией ржавеет большинство оборудования, мосты, путепроводы, вышки ЛЭП; металлоконструкции и корпуса судов, соприкасающиеся с речной или морской водой, растворами солей и влажным воздухом.
Коррозия с водородной деполяризацией имеет место:
1) при большой концентрации [H+] в растворе (коррозия Fe, Zn, Cd, Ni в растворах кислот);
2) в отсутствие в растворе кислорода при отрицательных значениях электродных потенциалов металлов, когда они не покрыты оксидными пленками и способны вытеснять водород из воды.
Рассмотрим наиболее распространенный коррозионный процесс, связанный с коррозией железа в атмосферных условиях, в которых Fe под действием воздуха и воды быстро покрывается ржавчиной.
Коррозионный процесс при этом можно записать следующим образом:
 Fe – 2e = Fe2+ 2
Fe – 2e = Fe2+ 2
O2 + 2 H2O + 4e = 4OH- 1
2 Fe + O2 + 2H2O = 2 Fe2+ + 4OH-
Вторичным коррозионным процессом является стадия осаждения железа в виде гидроксида железа (II), а затем под действием кислорода воздуха и в виде гидроксида железа (III)
1) Fe2+ + 2OH- = Fe(OH)2 ; 2) 2Fe(OH)2 + ½О2 + Н2О = 2Fe(OH)3
Эти продукты коррозии могут претерпевать дальнейшие превращения с образование сложных гидратированных оксидов FeO· Fe2О3 · nH2O – так называемой ржавчины.
Факторы, влияющие на коррозию металлов. Наиболее простой моделью коррозионного процесса, идущего по электрохимическому механизму, является модель коррозионного гальванического элемента. Возникновение катодных и анодных участков на поверхности металла связано с химической и геометрической неоднородностью поверхности, механическими напряжениями,
неоднородностью коррозионной среды, температурным градиентом поверхности, контактом с другими металлами и т.п. Рассмотрим наиболее распространенные случаи.
Химическая неоднородность поверхности.Часто в роли катодов в коррозионных микрогальванических элементах выступают включения: неметаллов, оксидов, нитридов, карбидов и др. В частности, в чугуне – это микровключения графита, в стали – кристаллиты цементита (Fe3C).
На рис. 4 приведена схема разрушения углеродистой стали с кислородной и водородной деполяризациями. Коррозионный микрогальванический элемент образуется из зерен железа и его соединения – карбида железа (Fe3C),отличающихся по значениям электрохимической активности (потенциалов).
(-) А (α-Fe): Fe – 2e → Fe2+ PH<7
(+)K (Fe3C): 2H+ + 2e → H2
∑ Fe +2H+ → Fe2+ + H2
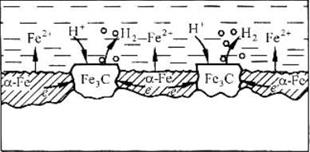
а)
(-) А (α-Fe): Fe – 2e → Fe2+ 2 PH≥7
(+)K (Fe3C): O2 + 2H2O + 4e → 4OH- 1
+O2
∑ 2Fe + O2 + 2H2O → 2Fe(OH)2 → mFexOy•nH2O
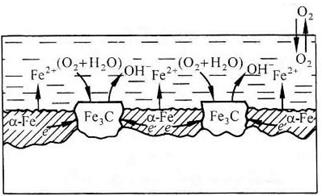
б)
Рис. 4. Схема коррозионного разрушения стали с водородной (а) и кислородной (б) деполяризациями
Геометрическая неоднородность связана с наличием шероховатости поверхности, наличия острых углов, граней, которые приводят к разным значениям энергии Гиббса на отдельных участках поверхности и, следовательно, к разным потенциалам Е1 иЕ2. На
выступах количество оборванных связей металла больше, чем во
впадинах, соответственно и энергия Гиббса выпуклого участка больше, а потенциал поверхности на нем более отрицательный (выступ является анодом).


 G
G  1 = - zFЕ1
1 = - zFЕ1



 ●
●
G2 = - zFЕ2 G1 > G2 ; Е1< Е2
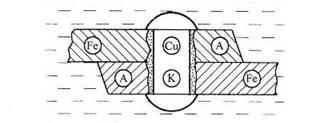
Контактная коррозия металлов. Электрохимическая коррозия может развиваться в результате контакта двух различных металлов. В результате будет возникать не микро-, а макрогальванопара.
Сочетания металлов, сильно отличающихся значениями электродных потенциалов, в технике недопустимы (например, скрутки проводов алюминий – медь, соединение железа алюминиевыми или медными клепками и т.д.).
На рис.5 показана коррозия железа, находящегося в контакте с медью. Возникает коррозионный гальванический элемент, в котором железо является анодом (Е°= -0,44 В), а медь – катодом (Е°= 0,34 В). Анодный процесс будет представлять собой растворение железа, катодный же будет определяться видом и составом коррозионной среды.
Дата добавления: 2015-07-22; просмотров: 4375;
