Зона коррозии
Рис. 5. Коррозия при контакте двух металлов
Влияние неоднородности состава коррозионной среды может приводить к образованию микрогальванопар даже на поверхности одного и того же металла. Примером может служить коррозия
металла под каплей воды (рис.6). Так как поверхностные слои воды содержат больше растворенного кислорода, чем внутренние, поверхность металла в центре под каплей оказывается более активной (анодный участок), а на периферии капли будет наблюдаться восстановление кислорода (катодный участок). После высыхания капли в ее центре появляется довольно глубокое пятно ржавчины.
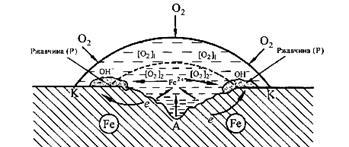
Рис. 6. Схема коррозии железа под каплей воды
Подобные гальванопары возникают очень часто при коррозии бытового и промышленного оборудования и в подземных сооружениях, из-за неравномерной аэрации кислородом отдельных участков поверхности металла. В качестве примера может служить коррозия стальной сваи, закопанной в речное дно (рис 7).
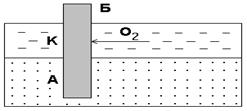
Рис. 7. Коррозия в результате неравномерного доступа кислорода. Б – свая; А – анодный участок; К – катодный участок
Часть сваи, находящаяся в воде, омывается растворенным в ней кислородом и, будет играть роль катода. Почва практически не
содержит растворенного кислорода и та часть сваи, которая
находится в ней, будет анодом и подвергается разрушению.
Механические напряжения. Микрогальванопары могут возникать при действии внешних и внутренних механических напряжений (например, изгиб и провисание балки, напряженные сварные швы). Коррозия в этом случае приводит к межкристаллитному растрескиванию или так называемой "ножевой" коррозии. Такой вид коррозии возникает из-за того, что на растянутой стороне балки межатомные связи растянуты и более слабы, чем на верхней стороне. Энергия Гиббса на этой стороне балки равна ∆G1. На сжатой стороне балки энергия Гиббса имеет более отрицательные значения ∆G2. Так как ∆G связано с потенциалом ∆G = -nFЕ, то на сжатой стороне имеем более положительный потенциал Е2 (катод), а на растянутой – более отрицательный потенциал Е1 (анод).
Таким образом, механические напряжения всегда приводят к возникновению гальванопар с ЭДС = Е2 – Е1. При этом в области растяжений наблюдается растворение металла, а в области сжатий (катодные участки) восстанавливается окислитель (Н+ или О2).
Кинетика коррозионных процессов.Имеется много примеров того, как более активные металлы растворяются значительно медленнее, чем менее активные. Например, скорость коррозии алюминия в атмосферных условиях значительно меньше скорости коррозии железа (-0,44 В), хотя стандартный электродный потенциал алюминия более отрицателен (-1,66 В). Это говорит о том, что помимо влияния термодинамических факторов на процессы коррозии необходимо учитывать также и кинетические факторы, из которых наиболее важным является способность металлов переходить в пассивное состояние.
Процесс пассивации металлов связан с образованием на их поверхности тонких пленок малорастворимых соединений - оксидов, гидроксидов, солей или их смесей. Эти пленки блокируют поверхность и препятствуют переносу электронов и окислителя к поверхности металла.
Известно, что коррозия металла с водородной деполяризацией
протекает тем быстрее, чем меньше перенапряжение реакции
выделения водорода (hН2,В) на нем (см. табл. 3).
Например, Е°Pb2+/Pb = - 0,126 В, т.е. свинец термодинамически неустойчив в кислых средах, однако с разбавленными серной и соляной кислотами металл не взаимодействует, так как на свинце hН2 = -1,56 В.
По этой же причине цинк (Е° (Zn2+/Zn) = -0,76 В) тоже неустойчив в кислых средах. Однако, из-за большого перенапряжения водорода, он очень медленно вытесняет водород из кислот.
В контакте цинка с медью (Zn | H+ | Cu), на Cu восстановление водорода протекает значительно быстрее (hН2 на меди на 0,4 В меньше, чем на Zn). По этой причине в контакте с медью цинк растворяется очень активно, что сопровождается интенсивным выделением водорода на меди.
Дата добавления: 2015-07-22; просмотров: 2795;
