Защита металлов от коррозии
В соответствии с рассмотренными ранее механизмами коррозию металлов можно затормозить изменением потенциала металла, пассивацией металла, снижением концентрации окислителя, изоляцией поверхности металла от окислителя, изменением состава металла и др. При разработке методов защиты от коррозии используют указанные способы снижения скорости коррозии, которые меняются в зависимости от характера коррозии и условий ее протекания. Выбор способа определяется его эффективностью, а также экономической целесообразностью. Все методы защиты условно делятся на следующее группы: а) легирование металлов; б) защитные покрытия (металлические, неметаллические); в) электрохимическая защита; г) изменение свойств коррозионной среды; д) рациональное конструирование изделий
Легирование металлов.Это эффективный (хотя и дорогой) метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивность металла. В качестве таких компонентов применяют хром, никель, вольфрам и др.
Широкое применение нашло легирование для защиты от газовой коррозии. Введение некоторых добавок к сталям (титана, меди, хрома 'и никеля) приводит к тому, что при коррозии образуются плотные продукты реакции, предохраняющие сплав от дальнейшей коррозии. При этом используют сплавы, обладающие жаростойкостью и жаропрочностью,
Жаростойкость — стойкость по отношению к газовой коррозии при высоких температурах. Жаропрочность — свойства конструкционного материала сохранять высокую механическую прочность при значительном повышении температуры. Жаростойкость обычно обеспечивается легированием металлов и сплавов, например, стали хромом, алюминием и кремнием. Эти элементы при высоких температурах окисляются энергичнее, чем железо, и образуют при этом плотные защитные пленки оксидов, например, SiCb, А12Оз и Сг203. Хром и кремний улучшают также жаропрочность сталей. Стали, легированные 4-9% хрома, молибденом или кремнием, применяют, например, в парогенераторе- и турбостроении. Сплав, содержащий 9 -12% хрома, применяют для изготовления лопаток газовых турбин, деталей реактивных двигателей, в производстве двигателей внутреннего сгорания и т. п.
Сплавы Cr-Al-Fe обладают исключительно высокой жаростойкостью. Например, сплав, содержащий 30% Сг, 5 % А1, 0,5% Si, устойчив на воздухе до 1300 С. Эти сплавы используют, в частности, в качестве материала дня изготовления спиралей и деталей нагревательных элементов печей сопротивления. К их недостаткам относятся низкая жаропрочность и склонность к хрупкости при комнатной температуре после продолжительного нагрева на воздухе, вызываемая в известной степени образованием нитридов алюминия. По этой причине положение спиралей в печах должно быть фиксировано, а для беспрепятственного термического расширения и сжатия спирали
обычно гофрируют. Жаростойкость никеля еще больше повышается при добавлении хрома. Сплав, содержащий 20% Сг и 80% Ni, устойчив на воздухе до 1150 С. Этот сплав — один из лучших жаростойких и жаропрочных сплавов.
Легирование также используется с целью снижения скорости электрохимической коррозии, особенно коррозии с выделением водорода. К коррозионностойким сплавам, например, относятся нержавеющие стали, в которых легирующими компонентами служат хром, никель и другие металлы.
Защитные покрытия.Слои, искусственно создаваемые на поверхности металлических изделий и сооружений для предохранения их от коррозии, называются защитными покрытиями. Если наряду с защитой от коррозии покрытие служит также для декоративных целей, его называют защитно-декоративным. Выбор вида покрытия зависит от условий, в которых используется металл.
Металлические покрытия.Материалами для металлических защитных покрытий могут быть как чистые металлы (цинк, кадмий, алюминий, никель, медь, хром, серебро и др.), так и их сплавы (бронза, латунь и др.). По характеру поведения металлических покрытий при коррозии их можно разделить на катодные н анодные. К катодным покрытиям относятся покрытия, потенциалы которых в данной среде имеют более положительное значение, чем потенциал основного металла. В качестве примеров катодных покрытий на стали можно привести Си, Ni, Ag. При повреждении покрытия (или наличии пор) возникает коррозионный элемент, в котором основной материал в поре служит анодом и растворяется, а материал покрытия — катодом, на котором выделяется водород или поглощается кислород (рис. 10.8, а). Следовательно, катодные покрытия могут защищать металл от коррозии лишь при отсутствии пор и повреждений покрытия. Анодные покрытия имеют более отрицательный потенциал, чем потенциал основного металла. Примером анодного покрытия может служить цинк на стали. В этом случае основной металл будет катодом коррозионного элемента, поэтому он не корродирует. Потенциалы металлов зависят от состава растворов, поэтому при изменении состава раствора может меняться и характер покрытия. Так, покрытие стали оловом в растворе H2SO4 — катодное, а в растворе органических кислот — анодное.
Для получения металлических защитных покрытий применяются различные способы: электрохимический (гальванические покрытия), погружение в расплавленный металл, металлизация, термодиффузионный и химический. Из расплава получают покрытие цинка (горячее цинкование) и олова (горячее лужение).
Металлизация — способ получения металлических защитных покрытий на различных сооружениях (мосты, детали судов, большие баки и др.); при этом способе расплавленный металл с помощью струи сжатого воздуха наносится на защищаемую поверхность. Этим методом можно получать слои почти любой толщины и с хорошим сцеплением с основным металлом. К преимуществам этого способа относится возможность нанесения покрытия на собранные конструкции. Иногда для повышения коррозионной стойкости поры покрытия заполняют термопластичными смолами.
Неметаллические защитные покрытия.Они могут быть как неорганическими, так и органическими. Защитное действие этих покрытий сводится в основном к изоляции металла от окружающей среды. В качестве неорганических покрытий применяют неорганические эмали, оксиды металлов, соединения хрома, фосфора и др. К органическим относятся лакокрасочные покрытия, покрытия смолами, пластмассами, полимерными пленками, резиной.
Эмалированию подвергают черные и цветные металлы, которые используют при производстве аппаратуры в фармацевтической, химической, пищевой отраслях промышленности, при производстве изделий домашнего обихода.
Эмалирование также применяется для защиты от газовой коррозии. Неорганические эмали по своему составу являются силикатами, т.е. соединениями кремния. К основным недостаткам таких покрытий относятся хрупкость и растрескивание при тепловых и механических ударах.
Некоторые защитные покрытия образуются непосредственно на поверхности металла. Образование на поверхности металлических изделий защитных оксидных пленок в технике называют оксидированием. Некоторые процессы имеют специальные названия. Так, например, процессы нанесения на сталь оксидных пленок ( 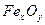 иногда называют воронением, электрохимическое оксидирование алюминия — анодированием . Оксидные покрытия на стали можно получить при высокотемпературном окислении на воздухе или погружением в горячие концентрированные растворы щелочей, содержащих персульфаты, нитраты или хлораты металлов. В сухом воздухе оксидные пленки достаточно стойки; во влажной атмосфере, и особенно в воде, защитные свойства их невысоки. Защитные свойства оксидных пленок повышают пропиткой их маслом..
иногда называют воронением, электрохимическое оксидирование алюминия — анодированием . Оксидные покрытия на стали можно получить при высокотемпературном окислении на воздухе или погружением в горячие концентрированные растворы щелочей, содержащих персульфаты, нитраты или хлораты металлов. В сухом воздухе оксидные пленки достаточно стойки; во влажной атмосфере, и особенно в воде, защитные свойства их невысоки. Защитные свойства оксидных пленок повышают пропиткой их маслом..
Лакокрасочные покрытия наиболее распространены и незаменимы. Лакокрасочное покрытие должно быть сплошным, беспористы, газо- и водонепроницаемым, химически стойким, эластичным, обладать высоким сцеплением с материалом, механической прочностью и твердостью. К некоторым покрытиям предъявляются специальные требования: повышенная стойкость при высоких температурах, стойкость против кислот, щелочей, бензина и т. п. Лакокрасочные покрытия делятся на две большие группы: лаки и краски (эмали). Краски (эмали) представляют собой смесь нерастворимых частиц пигмента (красителя), взвешенных в однородном органическом связующем. Лаки обычно состоят из смеси смолы или высыхающего масла с летучим растворителем. В процессе сушки происходит полимеризация смолы или масла и испарение растворителя. Пигменты обычно представляют собой оксиды металлов, например ZnO, TiCb, СrОз, Ре2Оз или такие соединения, как ZnCrO4, PbS 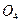 , Ва
, Ва 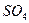 и т.п. Связующими могут быть растительные масла (льняное, древесное, ореховое, конопляное, подсолнечное, соевое и др.). Если требуется стойкость к кислотам, щелочам или к воздействию высоких температур и особенно для работы в условиях постоянного контакта с водой, в качестве связующих или их компонентов используют синтетические смолы.
и т.п. Связующими могут быть растительные масла (льняное, древесное, ореховое, конопляное, подсолнечное, соевое и др.). Если требуется стойкость к кислотам, щелочам или к воздействию высоких температур и особенно для работы в условиях постоянного контакта с водой, в качестве связующих или их компонентов используют синтетические смолы.
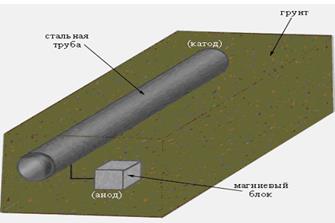
Электрохимическая защита.Этот метод защиты основан на торможении анодных или катодных реакций коррозионного процесса. Электрохимическая защита осуществляется присоединением к защищаемой конструкции металла с более отрицательным значением электродного потенциала — протектора, а также катодной (катодная защита) или анодной (анодная защита) поляризацией за счет извне приложенного тока. Наиболее применима электрохимическая зашита в коррозионных средах с хорошей ионной электрической проводимостью. Катодная поляризация (защита) используется для защиты от коррозии подземных трубопроводов, кабелей. Катодную защиту применяют также к шлюзовым воротам, подводным лодкам, водным резервуарам, буровым платформам, морским трубопроводам и оборудованию химических заводов.
Сущность катодной защиты заключается в том, что защищаемое изделие подключается к отрицательному полюсу внешнего источника постоянного тока, поэтому оно становится катодом, а анодом служит вспомогательный, обычно стальной электрод. Вспомогательный электрод (анод) растворяется
М — пе 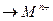 ,
,
а на защищаемом сооружении (катоде) выделяется водород
2Н2О + 2е  Н2 +2OH .
Н2 +2OH .
При протекторной защите к изделию подсоединяют металл или сплав, потенциал которого значительно отрицательнее потенциала металла изделия. Такие металлы или сплавы называются протекторами. В качестве материала протекторов используют сплавы алюминия, магния и цинка.
|
| Рисунок 15.5 - Катодная защита подземного трубопровода. |
Изменение свойств коррозионной среды.Для снижения arpecсивности среды уменьшают концентрацию компонентов, опасных в коррозионном отношении. Например, в нейтральных средах коррозия обычно протекает с поглощением кислорода. Его удаляют деаэрацией (кипячение, барботаж инертного газа) или восстанавливают с помощью соответствующих восстановителей (сульфиты, гидразин и т. п.) Например, О2 + N2H4 = N2 + 2H2O. Агрессивность среды может уменьшаться также при снижении концентрации ионов Н+, т. е. повышении рН (подщелачивании). Для защиты от коррозии широко применяют ингибиторы.
Ингибитором называется вещество, при добавлении которого в небольших количествах в среду, где находится металл, значительно уменьшается скорость коррозии металла. Ингибиторы применяют главным образом в системах, работающих с постоянным или мало обновляемым объемом раствора, например в некоторых химических аппаратах, системах охлаждения, парогенераторах и т. п. Они применяются при транспортировке газа и нефти, для защиты от коррозии горюче-смазочными веществами, а также в органических средах, морской воде и т. д. Особенно большое применение находят замедлители в процессах травления металлов для удаления с поверхности окалины или ржавчины.
По механизму своего действия на процесс электрохимической коррозии ингибиторы целесообразно разделить на адсорбционные и пассивационные.
По составу различают ингибиторы органические и неорганические. По условиям, в которых они применяются, их можно разделить на ингибиторы для растворов и летучие ингибиторы, дающие защитные эффект в условиях атмосферной коррозии. Так как эффективность действия ингибитора сильно зависит от рН сред, то можно разделить ингибиторы также на кислотные, щелочные и нейтральные.
Механизм действия значительного числа ингибиторов заключается в адсорбции ингибитора на коррозирующей поверхности и последующем торможении катодных или анодных процессов.
Адсорбционные ингибиторы уменьшают скорость коррозии за счет снижения интенсивности процесса или сокращения площади участков, лимитирующих процесс. К таким ингибиторам относятся органические вещества, содержащие N, P, S, О, Si, например, диэтиламин (СН3СН2) 2NH, уротропин N4(CH2)4, формальдегид СН2О, пиридин СбН5К и его производные.
В последние годы широко применяют летучие парофазные ингибиторы. Их используют для защиты машин, аппаратов и других металлических изделий во время их эксплуатации в воздушной атмосфере, при перевозке и хранении. Летучие ингибиторы вводятся в контейнеры, в упаковочные материалы или помещаются в непосредственной близости от рабочего агрегата. Вследствие достаточно высокого давления паров летучие ингибиторы достигают границы раздела металл — воздух и растворяются в пленке влаги, покрывающей металл. Далее они адсорбируются на поверхности металла. В качестве летучих ингибиторов используются обычно амины с небольшой молекулярной массой, в которые вводятся группы NОз или СОз, например бензатриазол, карбонат этаноламина, некоторые органические нитраты.
Пассивационные ингибиторы вызывают образование на поверхности металла защитных пленок и пассивацию металла. К ним относятся неорганические окислители, например NaN02, Na2Cr2C>7, Н2О2, и вещества, образующие с ионами корродирующего металла малорастворимые соединения (полифосфаты, силикаты и карбонаты натрия, соединения кальция, магния и др.). Некоторые органические соединения, например бензоат натрия, облегчают адсорбцию кислорода и этим вызывают пассивацию металла.
Рациональное конструированиеизделий должно исключать наличие или сокращать число и размеры особо опасных, с точки зрения коррозии, участков в изделиях или конструкциях (сварных швов, узких щелей, контактов разнородных по электродным потенциалам металлов и др.), а также предусматривать специальную защиту металла этих участков от коррозии.
Защита от коррозии блуждающими токами.Токи, ответвляющиеся от своего основного пути, называются блуждающими. Источниками блуждающих токов могут быть различные системы и устройства, работающие на постоянном токе, например железнодорожные пути электропоездов, трамвайные линии, заземления постоянного тока, установки для электросварки, электролизные ванны, системы катодной защиты и т. д.
.Коррозию блуждающими токами может, например, вызвать установленный на берегу дизель-генератор для сварки, соединенный заземленными проводами постоянного тока с находящимся в ремонте кораблем. Серьезные разрушения металла корпуса корабля могут возникать под воздействием той части тока, которая возвращается от сварочных электродов к береговой установке через корпус корабля и воду. В этом случае предпочтительнее устанавливать генератор на борту корабля и питать его переменным током, так как утечка в землю последнего вызывает менее сильную коррозию.
При низких плотностях блуждающего тока коррозия вследствие работы локальных микроэлементов протекает одновременно с коррозией блуждающими токами. При высоких плотностях тока в некоторых средах может начаться выделение кислорода.
Борьба с коррозией блуждающими токами заключается, прежде всего в их уменьшении. для электрифицированных железных дорог, у которых рельсы служат обратными проводами, это достигается поддержанием в хорошем состоянии электрических контактов между рельсами и увеличением сопротивления между рельсами и почвой. Коррозия блуждающими токами прекращается при соединении металлическим проводником с низким сопротивлением эксплуатируемой трубы с рельсами. Это называется дренажом.
Итак, к настоящему времени благодаря изучению механизма коррозии разработаны разнообразные методы защиты от коррозии, выбор которых определяется природой защищаемого металла, параметрами коррозионной среды и экономическими соображениями.
Вопросы для самоконтроля
1. Медь не вытесняет водород из разбавленных кислот. Почему? Однако, к медной пластине, опущенной в кислоту, прикоснуться цинковой, то на меди начинается выделение кислорода. Объясните это явление, составив уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
2. Объясните, почему в атмосферных условиях, цинк корродирует, а золото нет?
3. Возможна ли коррозия олова в водном растворе с рН = 6 при контакте с воздухом?
4. Приведите примеры анодных и катодных покрытий для кобальта. Составьте уравнения катодных и анодных процессов во влажном воздухе и в растворе соляной кислоты при нарушении целостности покрытия.
5. Скорость равномерной коррозии стального изделия составила 7,9 г/(м2·ч). Рассчитайте уменьшение толщины металла за единицу времени, принимая плотность стали равной плотности железа.
6. Рассчитайте парциальное давление кислорода, ниже которого газовая коррозия Сu при 298 К с образованием СuО невозможна. Рассчитайте температуру, выше которой
газовая коррозия в атмосфере кислорода (РО2= 1) с образованием СuО невозможна.
7. Во сколько раз возрастает толщина пленки при увеличении продолжительности газовой коррозии никеля и алюминия от 9 до 100 ч?
8.В стальной емкости находится природная вода, содержащая кислород 2 • 10 –3 моль/м3 и имеющая рН 8,0. Какой тип коррозии металла внутренней поверхности емкости возможен при 298 К? Ответ подтвердите расчетом. Рассчитайте время, которое потребуется для полной коррозии металла толщиной 1 мм, принимая δ = 10 –4 м, D = 10 –9 м2/с, ρ = 7,9 г/см3 и равномерный характер коррозии.
Заключение по модулю 3
Дата добавления: 2015-08-08; просмотров: 2368;
