Электрохимическая коррозия металлов
Этот вид коррозии всегда сопровождается возникновением гальванических пар и подразделяется на два вида: коррозия в растворах электролитов и атмосферная коррозия.
Термодинамически возможен процесс электрохимической коррозии, для которого соблюдается условие
∆G = -nFE < 0 (1)
где ∆G – изменение энергии Гиббса для процесса, кДж/моль; n – число электронов, принимающих участие в коррозионном, окислительно-восстановительном процессе; F = 96500 Кл – число Фарадея; E = Ек – Еа – ЭДС гальванического элемента, в котором протекает данный коррозионный процесс (Ек и Еа – потенциалы катодного и анодного процессов соответственно, в вольтах).
Таким образом, возможность протекания электрохимической коррозии металла определяется соотношением потенциалов анодного (окисление металла) и катодного (восстановление окислителя) процессов в данных условиях.
Ионы и молекулы раствора, обеспечивающие протекание катодного процесса, называются деполяризаторами. Чаще всего в качестве деполяризаторов выступают растворенные в электролите или воде молекулярный кислород или ионы водорода, либо то и другое вместе (рис.2).
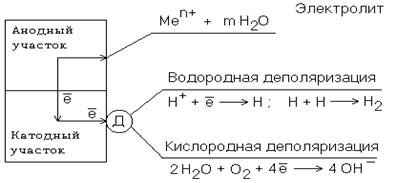
Рис. 2. Схема коррозионного процесса. Д – деполяризатор
Вследствие этого следует различать два вида электрохимической коррозии: с водородной (1) и кислородной деполяризацией (2):
1) анодный процесс: Ме – 2е = Ме2+
катодный процесс: 2Н+ + 2е = Н2 (медленная стадия)
2) анодный процесс: Ме – 2е = Ме2+
катодный процесс: О2 + 2Н2О +4е = 4ОН- (медленная стадия)
Анодный и катодный процессы всегда являются сопряженными.
Катодный процесс в обоих случаях является самым медленным и определяет скорость всего коррозионного процесса в целом.
Коррозия с водородной деполяризацией наблюдается в кислых средах, где содержание Н+ велико (рН ≤ 6); При большем рН, коррозия протекает с кислородной деполяризацией. Первый случай - наиболее опасный, так как водород, растворяясь в стали, создает повышенную хрупкость металла (водородное охрупчивание).Следует иметь в виду, что потенциалы водородного и кислородного электродов зависят от рН раствора по уравнениям:
Е(н+/н2) = - 0,059 · рН, В; Е(о2 /н2о) = 1,23 - 0,059 · рН, В
Эти зависимости в графическом варианте называются диаграммами Пурбэ (рис.3, кр.1 и 2).
 Е,В
Е,В
 1,2 Е(о2 /н2о) = 1,23 - 0,059 · рН, В
1,2 Е(о2 /н2о) = 1,23 - 0,059 · рН, В
 III – область металлов стойких во всех средах
III – область металлов стойких во всех средах
Дата добавления: 2015-07-22; просмотров: 2080;
