Открытые сопряженные системы.
Пример открытой с.с – бутадиен – 1,3.
1 2 3 4
СН2=СН–СН=СН2
| 1) Все атомы углерода в бутадиене находятся в sp2 гибридизации, значит молекула имеет плоское строение. 2) У каждого атома углерода есть р-негибридная орбиталь, расположенная перпендикулярно к плоскости молекулы. 3) Перекрывание р-орбиталей происходит между 1 и 2, 3 и 4 атомами углерода, то есть там, где есть π – связь, а также между 2 и 3 атомами тоже. |
Вследствие этого происходит делокализация (выравнивание) электронной плотности сопряженных π – связей и образуется единое π – электронное облако, охватывающее все четыре атома углерода.
Выравнивание электронной плотности π – связей сопряженной системы называется сопряжением.
Сопряжение подтверждается следующими фактами:
1) вследствие выравнивания электронной плотности происходит выравнивание длин связей (одинарные становятся короче, двойные – длиннее). Все связи в бутадиене имеют длину 0, 140 нм.
2) Сопряженные системы термодинамически более устойчивы.
3) Своеобразие химических свойств: в реакциях присоединения у бутадиена разрываются одновременно обе π – связи (так как это единая π – система), к 1и 4 атому углерода присоединяется реагент, а между 2 и 3 атомами углерода образуется новая π – связь.
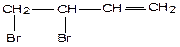 1,2–присоединение
1,2–присоединение


 СН2=СН–СН=СН2 + Br2
СН2=СН–СН=СН2 + Br2
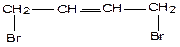
 1,4–присоединение
1,4–присоединение
Дата добавления: 2015-08-11; просмотров: 907;
