Индуктивный эффект. Связь между атомами может быть неполярной или полярной в зависимости от электроотрицательности атомов (ЭО).
Связь между атомами может быть неполярной или полярной в зависимости от электроотрицательности атомов (ЭО).
ЭО –это способность атома притягивать валентные электроны. Существует шкала ЭО, разработанная американским ученым Л. Полингом на основе энергии связи.
F O N Cl Br I C H Li Na
4 3,5 3,0 3,0 2,8 2,6 2,5 2,2 1,0 0,9
Элементы, ЭО которых меньше, чем ЭО атома водорода (2,2), называются электроположительными, они увеличивают электронную плотность на атоме С.
–δ +δ
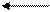 С Na
С Na
2,5 0,9
Элементы, ЭО которых больше, чем 2,2, называются электроотрицательными, они уменьшают электронную плотность на атоме С.
+δ –δ
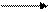 С Cl
С Cl
2,5 3,0
Таким образом, при наличии в молекуле различных по своей ЭО атомов, происходит смещение электронной плотности в сторону более электроотрицательного. Влияние атома передается и на соседние связи, что приводит к перераспределению электронной плотности в молекуле.
Смещение электронной плотности в молекуле вдоль σ–связей под действием заместителя называется индуктивным эффектом.Обозначается буквой I, изображается стрелкой по σ–связи. По мере удаления заместителя влияние его ослабевает.
Например, при введении в молекулу пропана атома хлора вместо атома водорода, происходит смещение электронной плотности к атому хлора по всей цепи σ–связей. Это и есть индуктивный эффект.
+δ΄΄΄ +δ΄΄ +δ΄ –δ
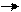

 СН3 СН2 СН2 Cl –I
СН3 СН2 СН2 Cl –I
2,5 3,0
δ΄΄΄ < δ΄΄ < δ΄
Если электронная плотность смещается к заместителю – это отрицательный индуктивный эффект (–I).
Если электронная плотность смещается от заместителя в молекулу – то положительный индуктивный эффект (+I).
+I проявляют: алкильные заместители (CH3, C2H5, C3H7 и т.д. ), металлы, анионы (О–)
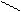
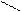 –I проявляют: Cl, Br, OH, NH2, NO2, –OCH3, –C = O , –C = O , – SO3H, –C≡N
–I проявляют: Cl, Br, OH, NH2, NO2, –OCH3, –C = O , –C = O , – SO3H, –C≡N
H OH
Под действием заместителя электронная плотность в молекуле либо увеличивается, либо уменьшается, что определяет его реакционную способность.
I – это способ передачи взаимного влияния атомов.
Сопряженные системы. Сопряжение.
В соединении может быть несколько двойных связей и они могут быть расположены по разному относительно друг друга. Рассмотрим на примере пентадиена С5Н8.
1 2 3 4 5
С=С–С–С=С пентадиен –1,4
1 2 3 4 5
С=С=С–С–С пентадиен- 1,2
1 2 3 4 5
С=С–С=С–С пентадиен- 1,3
Соединения, в которых двойные связи чередуются с одинарными, называются сопряженными системами. Существуют открытые сопряженные системы (с.с) и замкнутые (циклические).
Дата добавления: 2015-08-11; просмотров: 996;
