Простая ( одинарная) связь Типы связей в биоорганических соединениях.
Органические молекулы образованы посредством ковалентных связей. Ковалентные связи возникают между двумя ядрами атомов за счет общей (обобществленной) пары электронов. Такой способ относится к обменному механизму. Образуются неполярные и полярные связи.
Неполярные связи характеризуются симметричным распределением электронной плотности между двумя атомами, которые эта связь соединяет.
Полярные связи характеризуются несимметричным ( неравномерным) распределением электронной плотности, происходит ее смещение в сторону более электроотрицательного атома.
Ряды электроотрицательности ( составлены в сторону уменьшения)
А) элементы: F > O > N > C1 > Br > I ~~ S > C > H
Б) атом углерода: C (sp) > C ( sp2 ) > C ( sp 3 )
Ковалентные связи могут быть двух типов: сигма ( σ) и пи ( π ).
В органических молекулах сигма (σ) связи образованы электронами, расположенными на гибридных( гибридизованных) орбиталях, электронная плотность располагается между атомами на условной линии их связывания.
π -Связи ( пи -связи) возникают при перекрывании двух негибридизованных р-орбиталей. Главные оси их располагаются параллельно друг другу и перпендикулярны линии σ -связи. Сочетание σ и π --связей носит название двойная( кратная) связь, состоит из двух пар электронов. Тройная связь состоит из трех пар электронов- одна σ - и две π -связи.( в биоорганических соединениях встречается крайне редко).
σ-Связи участвуют в образовании скелета молекулы, они являются главными , а π -связи можно рассматривать как дополнительные, но придающие молекулам особые химические свойства.
1.2. Гибридизация орбиталей атома углерода 6 С
Электронная конфигурация невозбужденного состояния атома углерода
выражается распределением электронов 1s 2 2s2 2p2 .
--↑- --↑-- ---
C --↑↓-
2 s 2p
Однако в биоорганических соединениях, как впрочем, и в большинстве неорганических веществ, атом углерода имеет валентность равную четырем.
Происходит переход одного из 2s электронов на свободную 2р орбиталь. Возникают возбужденные состояния атома углерода, создающие возможность образования трех гибридных состояний, обозначаемых как С sp3 , С sp2 , С sp .
Гибридная орбиталь имеет характеристики, отличные от «чистых» s, p, d- орбиталей и является « смесью» двух или более типов негибридизованных орбиталей.
Гибридные орбитали свойственны атомам только в молекулах.
Понятие гибридизации введено в 1931г Л.Полингом , лауреатом Нобелевской премии,.
Рассмотрим расположение в пространстве гибридных орбиталей.
С s p3 -↑-- -↑- -↑- --↑-
В возбужденном состоянии образуются 4 равноценные гибридные орбитали. Расположение связей соответствует направлению центральных углов правильного тетраэдра, величина угла между двумя любыми связями равна 109 0 28 ,.
В алканах и их производных ( спирты, галогеналканы, амины) все атомы углерода, кислорода, азота находятся в одинаковом гибридном sp3 cостоянии. Атом углерода образует четыре, атом азота три, атом кислорода две ковалентные σ-связи. Вокруг этих связей возможно свободное вращение частей молекулы относительно друг друга.
В возбужденном состоянии sp2 возникает три равноценные гибридные орбитали, расположенные на них электроны образуют три σ-связи , которые располагаются в одной плоскости, угол между связями 1200. Негибридизованные 2р - орбитали двух соседних атомов образуют π -связь. Она располагается перпендикулярно плоскости, в которой находятся σ -связи. Взаимодействие р-электронов носит в этом случае название « бокового перекрывания». Кратная связь не допускает вокруг себя свободного вращения частей молекулы. Фиксированное положение частей молекулы сопровождается образованием двух геометрических плоскостных изомерных форм, которые носят название : цис( cis ) – и транс(trans )- изомеры. ( цис-лат- по одну сторону, транс- лат- через).
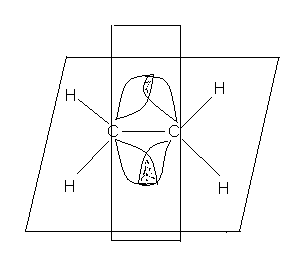
π -связь
Атомы, связанные двойной связью, находятся в состоянии гибридизации sp2 и
присутствуют в алкенах, ароматических соединениях, образуют карбонильную группу
>С=О, азометиновую группу ( имино группу) -СН= N-
-↑--
С sp2 - -↑-- -↑- -↑--
Структурная формула органического соединения изображается с помощью структур Льюиса ( каждая пара электронов между атомами заменяется черточкой)
С2 Н6 СН3 - СН3 H H
| |
H - С - С - H
| |
H H
1.3. Поляризация ковалентных связей
связь характеризуется Ковалентная полярная неравномерным распределением электронной плотности. Для обозначения направления смещения электронной плотности используют два условных изображения.
Полярная σ – связь. Смещение электронной плотности обозначают стрелкой вдоль линии связи. Конец стрелки направлен в сторону более электроотрицательного атома. Появление частичных положительных и отрицательных зарядов указывают с помощью буквы « б» « дельта» с нужным знаком заряда.
б + б- б+ б + б- б + б-
СН3 — > О<— Н СН3 — > С1 СН3 — > NН2
метанол хлорметан аминометан ( метиламин)
Полярная π -связь. Смещение электронной плотности обозначают полукруглой ( выгнутой) стрелкой над пи-связью также направленной в сторону более электроотрицательного атома. (  )
)
б +  б- б+
б- б+  б-
б-
Н 2 С = О СН3— С ===О
метаналь |
СН3 пропанон -2
Для проверки усвоения раздела рекомендуем ответить на вопросы:
1.Определите тип гибридизации атомов углерода, кислорода , азота в соединениях А, Б, В . Назовите соединения , используя правила номенклатуры IUPAC .
А. СН3-СН2- СН2-ОН Б. СН2 = СН – СН2- СН=О
В. СН3- N Н– С2 Н5
2. Сделайте обозначения, характеризующие направление поляризации всех указанных связей в соединениях ( А – Г )
А. СН3 – Вr Б. С2 Н5– О- Н В. СН3-NН- С2 Н5
Г. С 2 Н5 – СН= О
Дата добавления: 2015-08-11; просмотров: 1228;
