Переход примесей из воды в насыщенный пар.
Примеси, содержащиеся в воде, могут перейти в равновесный с ней насыщенный пар за счет уноса влаги паром (влажность пара ω) и за счет растворимости в насыщенном паре. В двухфазной равновесной системе между концентрациями растворенного вещества в паре Сп и воде Св поддерживается определенное соотношение, которое называется коэффициентом распределения Kp
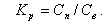
| (11.17) |
С учетом влажности пара количество примесей в паре
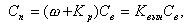
| (11.18) |
где Kвын - суммарный коэффициент выноса примесей в пар
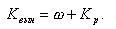
| (11.19) |
Унос влаги паром - гидродинамический процесс, рассматривался в гл.9.
Коэффициент распределения Кp характеризует физико-химические процессы, зависит от давления (температуры) в системе, свойств растворенного вещества и раствора, в котором кроме данного вещества обычно содержатся другие компоненты.
Коэффициент распределения Kp, рассчитанный по (11.17), называют еще видимым коэффициентом распределения (иногда обозначают Kpвид ). Коэффициент Kp не учитывает формы существования вещества в растворе: молекулярную и ионную.
Аналогично вводятся понятия истинных коэффициентов распределения для молекулярной Км и ионной Ки форм.
Формула для расчета молекулярного коэффициента распределения
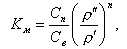
| (11.20) |
где n - координационное число, зависящее от природы растворенного вещества.
В логарифмических координатах
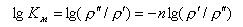
| (11.21) |
зависимость (11.20) представляет собой прямую линию, выходящую из точки р = ркр, ρ′ = ρ″, Км = 1, угол наклона которой определяется числом n. На (рис. 11.11) показана часть лучевой диаграммы.

I - весьма слабые электролиты (n < 1), в водных растворах почти недиссоциированы, коэффициент распределения при p = 11 МПа и выше составляет десятки процентов (типа гидратированных оксидов железа, алюминия и т.п.);
II - менее слабые электролиты (n = 1…3), коэффициент распределения в том же диапазоне - проценты (типа кремнекислоты);
III - сильные электролиты (n > 3), практически полностью диссоциированы, коэффициент распределения - десятые, сотые и меньшие доли процента (силикаты, сульфаты, фосфаты натрия, кальция).
Ионные формы растворенных веществ более гидратированы, координационное число n у них больше, а коэффициент распределения - меньше, чем у молекулярной формы. Видимый коэффициент распределения Кp зависит от Км, Ки и доли диссоциированных молекул.
Для слабых электролитов видимый коэффициент

| (11.22) |
где β - доля молекулярной формы в общей концентрации растворенного вещества; (1 – β) - доля ионной формы.
На β влияет не только давление, но и показатель рН. Поэтому при одном и том же давлении Кр будет различным в зависимости от показателя рН (рис. 11.12). Однако Кp для Fe3O4, SiO2, CuO в широких пределах изменения показателя рН (в рабочем диапазоне для паровых котлов) постоянен. Объясняется это тем, что для слабых электролитов β ≈ 1, (1-β) ≈ 0, т.е. Кp ≈ Kм.

Для сильных электролитов (соли сильных оснований и кислот) определяется степень диссоциации α (доля ионной формы вещества), которая зависит от концентрации электролита и давления (плотности), но не зависит от показателя рН. Коэффициент распределения (видимый) выражается через степень диссоциации в воде αв и средние коэффициенты активности в воде fв и паре fп:
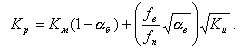
| (11.23) |
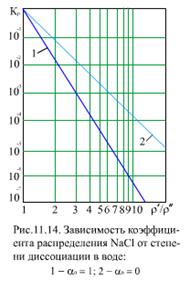
Из (11.23) видно, что Kp изменяется от значения 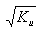 при αв =1 до Км при αв = 0 (рис. 11.13). Соответствующие лучи для
при αв =1 до Км при αв = 0 (рис. 11.13). Соответствующие лучи для 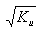 и Км представлены на (рис. 11.14).
и Км представлены на (рис. 11.14).
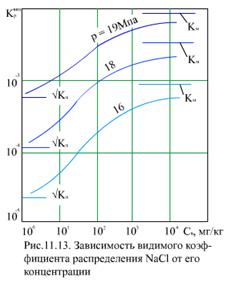
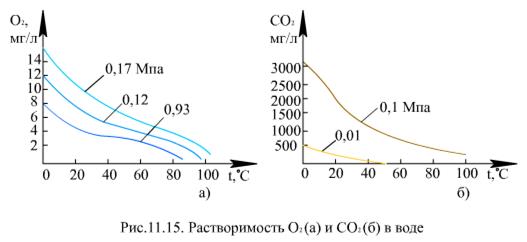
При 0 < αв<1 кривые для Kp расположены между этими лучами. Коэффициенты 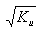 и Км при ρ′/ρ″ = 10 (р = 12 МПа) отличаются на два порядка (в 100 раз). Растворимость в воде тазов Н2, Не, Ne, молекулы которых имеют небольшие размеры, весьма мала. Газы СО2 Cl, H2S, SO2 NH3, молекулы которых образуют водородные связи и химические соединения с молекулами воды, растворяются хорошо. В области низких и умеренных температур (рис. 11.15) растворимость газов уменьшается с ростом температуры, достигая минимального значения для легких газов (гелий, водород, неон) при 50°С, для кислорода - при 90…100°С, для оксида углерода СО2 - при 150°С, затем происходит увеличение растворимости. Для аммиака NH3 минимума растворимости нет. В диапазоне давлений (до 30…35 МПа), при которых работают энергетические блоки, растворимость газов пропорциональна давлению.
и Км при ρ′/ρ″ = 10 (р = 12 МПа) отличаются на два порядка (в 100 раз). Растворимость в воде тазов Н2, Не, Ne, молекулы которых имеют небольшие размеры, весьма мала. Газы СО2 Cl, H2S, SO2 NH3, молекулы которых образуют водородные связи и химические соединения с молекулами воды, растворяются хорошо. В области низких и умеренных температур (рис. 11.15) растворимость газов уменьшается с ростом температуры, достигая минимального значения для легких газов (гелий, водород, неон) при 50°С, для кислорода - при 90…100°С, для оксида углерода СО2 - при 150°С, затем происходит увеличение растворимости. Для аммиака NH3 минимума растворимости нет. В диапазоне давлений (до 30…35 МПа), при которых работают энергетические блоки, растворимость газов пропорциональна давлению.
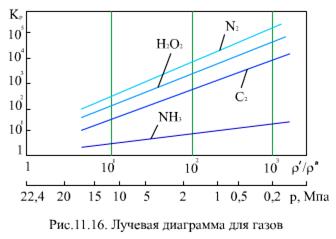
Коэффициент распределения летучих веществ между водой и паром больше 1 (рис. 11.16), т.е. при кипении воды летучие вещества переходят в пар. С одной стороны, на этом процессе основывается деаэрация воды, но, с другой стороны, это затрудняет поддержание в воде на необходимом уровне показателя рН, так как аммиак и летучие амины переходят в пар.
Для правильного выбора водно-химического режима парового котла и внутрибарабанных устройств необходимо знать не только Кp и ω, но и соотношение между ними.
На (рис. 11.17) показаны значения Кp для разных давлений в зависимости от силы электролита - показателя координатного числа n. Там же приведены обычные для барабанных котлов значения влажности пара ω = 0,02…0,05% (в долях ω = 0,0002…0,0005).
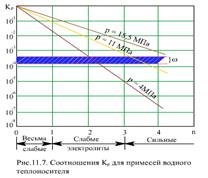
При низком давлении в барабане (р = 4 МПа) коэффициент распределения Кp выше влажности ω при n < 2 ((рис. 11.17), т.е. для весьма слабых и некоторых слабых электролитов. К ним относятся Fe3O4, А12O3, CuO, B2O3, SiO3. Продукты коррозии (Fe3O4, А12O3 и др.) имеют малую растворимость в воде, поэтому даже при высоком значении Kp концентрация их в паре мала.
Особое значение имеет кремнекислота H2SiO3 - в воде ее заметное количество, и в паре она хорошо растворяется. Сильные электролиты имеют Кp << ω, и их концентрация в воде особого влияния на качество пара не оказывает, если предусмотреть достаточную эффективность сепарации пара. По содержанию SiO2, в воде устанавливается предельно допустимое значение.
При среднем давлении (р = 11 МПа) весьма слабые и слабые электролиты (n < 3) имеют Кp > ω, причем для Fe3O4, А12O3 это превышение составляет примерно три порядка, для SiO2 - два порядка. Сильные электролиты имеют еще Кp < ω. Для этого давления становится актуальным для получения чистого пара снижение концентрации слабых электролитов в воде, улучшение сепарации и промывки пара.
При высоком давлении в барабане (р = 15,5 МПа) только очень сильные электролиты (n > 5) имеют коэффициент распределения Кр ниже, чем влажность пара ω, т.е. в насыщенный пар основное количество примесей поступает не с влажностью пара, а путем их растворения. Отсюда возникает задача обязательной промывки пара водой более чистой, чем котловая. Но при этом не следует принижать роль сепарации - в котловой воде часто содержатся не только растворенные примеси, но и взвеси, шлам с концентрацией Cввзв. Эта часть примеси уносится вместе с каплями воды.
Дата добавления: 2015-07-10; просмотров: 1985;
