Коррозия металла в пароводяном тракте парового котла.
Коррозией называется процесс разрушения металлов или сплавов при протекании физико-химических процессов на границе раздела металл-среда. Коррозия приводит к частичному или полному разрушению кристаллической решетки и изменению свойств материала, вплоть до его разрушения. Коррозия может вызываться химическими, электрохимическими, механическими причинами, влиянием нейтронного поля и другими факторами.
Различают общую и местную коррозию. Общая коррозия охватывает всю поверхность металла, смачиваемую теплоносителем; местная коррозия проявляется на отдельных участках поверхности и разделяется на питтинг-коррозию, крекинг-коррозию и избирательную.
Питтинг-коррозия протекает на отдельных небольших участках поверхности нагрева и проявляется в виде язв, коррозионных точек или пятен.
Крекинг-коррозия (коррозионное растрескивание) возникает на участках металла, находящихся под большим механическим напряжением. Проявляется крекинг-коррозия в виде трещин, проходящих по границам зерен металла или через сами зерна.
Избирательная коррозия представляет собой растворение какого-либо элемента, входящего в сплав.
Химическая коррозия подчиняется законам химических гетерогенных реакций и не сопровождается возникновением электрического тока, является результатом протекания химических реакций между металлом и рабочим телом (теплоносителем), когда теплоноситель не является электролитом (сухие газы, перегретый пар). Трубы, поступающие на изготовление поверхностей нагрева и соединительных участков, подвержены химической коррозии на воздухе при их изготовлении и хранении. Полученный при этом слой оксидов железа имеет переменную толщину и плотность, неустойчив. Перед пуском оборудования этот слой оксидов удаляется химической промывкой. В процессе пуска и работы оборудования необходимо создать условия для образования устойчивой защитной пленки.
Химическая коррозия протекает в пароперегревателях при t = 500…570°С (в этом случае ее называют также пароводяной коррозией) и может быть описана реакцией Шодрона
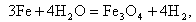
| (11.5) |
в результате которой на поверхности металла образуется магнетит Fe3O4, который стабилен и создает защитную пленку. При температуре на стенке свыше 570°С протекают реакции:
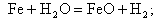
| (11.6) |
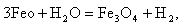
| (11.7) |
в результате которых образуется не только магнетит, но и вюстит FeO, оксидная пленка при этом имеет пониженные защитные свойства.
Хорошая защитная пленка магнетита должна быть плотной и иметь толщину (0,4…1,0)∙10-4 мм. При большей толщине оксидов пленка имеет малую механическую прочность и может разрушаться. Разрушение пленок наиболее интенсивно происходит при переменных режимах.
Оксидная пленка в пароперегревателях может разрушаться при попадании и осаждении на стенках различных солей (в результате нарушения режима работы барабана - вспенивания, заброса воды в пароперегреватель). При попадании на стенку пароперегревателя NaOH происходит не только разрушение защитной пленки, но и щелочная коррозия, коррозионное растрескивание аустенитной стали происходит и под воздействием хлоридов.
Для предотвращения разрушения оксидных пленок ограничивают скорость протекания пароводяной коррозии за счет хромирования, никелирования или насыщения алюминием поверхности стали, стремятся не допускать попадания в пароперегреватель едкого натра, хлоридов и других примесей.
Электрохимическая коррозия - это химическая коррозия, которая сопровождается протеканием электрического тока, возникает в случае, когда теплоноситель является электролитом, при этом на границе металл - рабочее тело возникают микрогальванические (коррозионные) элементы. Электрохимической коррозии подвержены все поверхности энергетических блоков, омываемые водой и пароводяной смесью. Деление на химическую и электрохимическую коррозию условно, во многих случаях оба процесса протекают одновременно, влияя друг на друга.
Особенностью коррозии является возникновение микрогальванических элементов на границе металл - рабочее тело. Анодный и катодный процессы могут протекать поочередно на одном и том же месте, или, в большинстве случаев, они разделены пространственно (рис. 11.2).
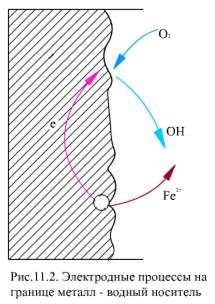
Анодный процесс - окисление металла, в результате чего ион металла Fe2+ переходит в воду, а электроны накапливаются в металле
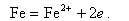
| (11.8) |
На катоде происходит ассимиляция (поглощение) электронов деполяризаторами, в качестве которых могут выступать H+ или О2-,
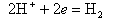
| (11.9) |
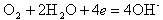
| (11.10) |
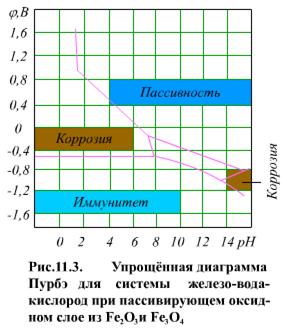
На аноде создается двойной электрический слой, электроны в металле образуют отрицательную внутреннюю часть, гидратированные ионы металла - положительную внешнюю часть. При этом появляется электрохимический (электродный) потенциал катодного или анодного процесса j и в растворе возникает движение ионов, а в металле - электронов, т.е. в системе возникает ток i. Анодный ток характеризуется удалением от металла его ионов, т.е. анодный ток пропорционален скорости анодного растворения металла, скорости его коррозии. На катодном участке электроны передаются деполяризаторам, находящимся в растворе, которые восстанавливаются. Для анализа свойств системы железо-вода-кислород используются диаграммы j =f(pH) или диаграммы Пурбэ.
Эти диаграммы показывают связь между электродным потенциалом металла φ, водородным показателем рН водного раствора и термодинамически устойчивыми формами оксидов железа, при этом учитывается и растворимость получаемых оксидов или гидроксидов железа.
На (рис. 11.3) показана упрощенная диаграмма Пурбэ для системы железо-вода-кислород. При определенных сочетаниях φ и рН могут быть: зона коррозии металла (присутствуют ионы Fe+2, Fe+3, HFeO-2 ); зона иммунитета (железо не корродирует); зона пассивности (зона пассивации; в этой зоне: железо не корродирует, так как образуется защитная оксидная пленка из Fe2O3 или из смеси Fe2O3 и Fe3O4).
Из диаграммы Пурбэ (рис. 11.3) видно, что для системы железо-вода-кислород имеются две коррозионные зоны - при высоком и низком значениях рН. Коррозия металла в этих зонах равномерна. Воздействуя на среду каким-либо восстановителем, потенциал электрода можно понизить до значений зоны иммунитета. Металл в зоне иммунитета термодинамически устойчив и не корродирует. Второй способ защиты металла: введение в систему окислителя с увеличением окислительно-восстановительного потенциала поверхности металла до перехода в зону пассивности. Железо в зоне пассивности термодинамически неустойчиво. Увеличение концентрации окислителя улучшает защитные свойства пленки.
При температуре свыше 200°С образование защитной пленки на поверхности металла протекает одновременно по двум механизмам - химической и электрохимической коррозии.
В поверхностном слое металла происходит окисление железа по уравнению химической коррозии (11.5).
Слой магнетита растет от начальной границы металла а (рис. 11.4) внутрь основного металла, образуя так называемый топотактический слой б (внутренний слой) защитной пленки.
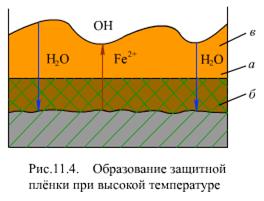
Образовавшиеся ионы Fe2+ (в результате электрохимической коррозии поверхности металла) диффундируют через защитную пленку и в растворе реагируют с гидроксильными ионами, образовавшимися на катодном участке
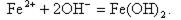
| (11.11) |
Это соединение превращается в магнетит (по реакции Шикорра)
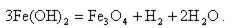
| (11.12) |
Образовавшийся в растворе магнетит кристаллизуется и адсорбируется на поверхности и образует менее плотный внешний слой в (эпитактический слой) защитной пленки.
Таким образом, при высокой температуре защитная оксидная пленка состоит из двух слоев: внутреннего слоя, по своим характеристикам (плотность, теплопроводность) близкого к основному материалу, и внешнего слоя, состоящего из более или менее плотноупакованных кристаллов магнетита, пропитанных теплоносителем, плотность его и теплопроводность меньше основного металла и внутреннего слоя.
Разновидностями электрохимической коррозии являются щелочная и кислотная коррозии, которые определяются локальным изменением показателя рН среды. Минимальная скорость растворения защитной пленки Fe3O4 соответствует значениям показателя рН300 (при t = 300°С) от 6 до 9. При показателе рН < 6 пленка магнетита начинает интенсивно растворяться, металл корродирует (кислотная коррозия), аналогично при показателе рН300 > 9 (щелочная коррозия). Но при общем допустимом значении рН возможны места концентрирования кислоты или основания на границе металл - вода. Концентрирование электролитов происходит в пористых отложениях примесей, шлама, имеющих определенную площадь распространения. При этом коррозия будет равномерной по этой площади.
Щелочная равномерная коррозия возникает при фосфатном водном режиме, когда возможно появление свободного едкого натра. При концентрации в порах NaOH 15…20% сталь начинает растворяться.
Дата добавления: 2015-07-10; просмотров: 2187;
