Теория мономолекулярной адсорбции Ленгмюра
Теория мономолекулярной адсорбции была предложена американским учёным Ленгмюром в 1915г. Им использованы представления об адсорбционных силах, впервые выдвинутые русским учёным Л.Г. Гурвичем.
Теория мономолекулярной адсорбции Ленгмюра основывается на следующих положениях.
1.Адсорбция является локализованной и вызывается силами близкими к химическим.
2.Адсорбция происходит не на всей поверхности адсорбента, а на активных центрах, которыми являются выступы либо впадины на поверхности адсорбента, характеризующиеся наличием так называемых свободных валентностей. Активные центры считаются независимыми (т.е. один активный центр не влияет на адсорбционную способность других), и тождественными.
3.Каждый активный центр способен взаимодействовать только с одной молекулой адсорбата; в результате на поверхности может образоваться только один слой адсорбированных молекул.
4.Процесс адсорбции является обратимым и равновесным – адсорбированная молекула удерживается активным центром некоторое время, после чего десорбируется; т.о., через некоторое время между процессами адсорбции и десорбции устанавливается динамическое равновесие.
Исходя из этих положений Ленгмюр вывел простейшее общее уравнение изотермы адсорбции.
Пусть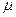 –число молей адсорбтива, налетающих на поверхность 1 см2 за 1с.;
–число молей адсорбтива, налетающих на поверхность 1 см2 за 1с.;
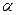 –
–  доля молекул, удерживаемых на поверхности адсорбционными силами;
доля молекул, удерживаемых на поверхности адсорбционными силами;
 –число молекул, улетающих с единицы поверхности адсорбента (1 см2) за единицу времени (1 с), полностью насыщенной молекулами адсорбтива;
–число молекул, улетающих с единицы поверхности адсорбента (1 см2) за единицу времени (1 с), полностью насыщенной молекулами адсорбтива;
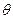 –доля поверхности, занятая адсорбтивом;
–доля поверхности, занятая адсорбтивом;
 –доля свободной поверхности.
–доля свободной поверхности.
Тогда количество молекул na, адсорбируемых единицей поверхности в единицу времени, долно быть равно количеству налетающих молекл, помноженному на долю удерживаемых молекул и на долю свободной поверхности:
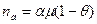 –количество адсорбированных молекул.
–количество адсорбированных молекул.
Количество молекул nд, десорбирующихся с единицы поверхности в единицу времени равно количеству молекул, улетающих с единицы полностью насыщенной поверхности, помноженной на долю занятой поверхности:
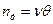 – количество улетающих молекул.
– количество улетающих молекул.
При достижении равновесия 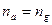 :
:
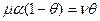
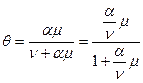
т.к. μ пропорционально давлению газа р: 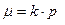 и
и 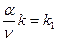 =>
=>
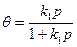 ,
,
Или через скорости: в состоянии равновесия 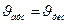
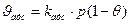
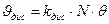 ,
,
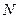 - количество молекул 1 единице площади.
- количество молекул 1 единице площади.

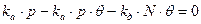
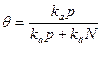
и числитель и знаменатель делим на kдN:

обозначим 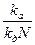 через k, тогда уравнение примет следующий вид:
через k, тогда уравнение примет следующий вид:
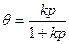
Максимально возможная величина адсорбции Г∞ (удельная адсорбция) достигается при условии, что все активные центры заняты молекулами адсорбата, т.е. θ = 1. Если
 =>
=>
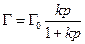 - уравнение изотермы
- уравнение изотермы
Дата добавления: 2015-08-11; просмотров: 1842;
