Фундаментальное уравнение адсорбции Гиббса
Для любой гетерогенной системы, объединённое уравнение I и II начала термодинамики можно представить в виде:
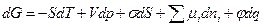 ,
,
где 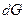 - энергия Гиббса, S – энтропия, Т – температура, V – объём, р – давление, σ – поверхностное натяжение, S – площадь поверхности,
- энергия Гиббса, S – энтропия, Т – температура, V – объём, р – давление, σ – поверхностное натяжение, S – площадь поверхности, 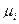 - химический потенциал компонента
- химический потенциал компонента 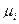 ;
; 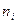 – число молей компеонента i;
– число молей компеонента i; 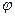 – электрический потенциал;
– электрический потенциал; 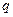 – количество электричества.
– количество электричества.
Уравнение выражает приращение энергии Гиббса системы через алгебраическую сумму приращений других видов энергии. Из этого уравнения видно, что возможны следующие превращения поверхностной энергии: а) в энергию Гиббса, б) в теплоту, в) в химическую энергию, г) в механическую энергию, д) в электрическую энергию.
Превращение поверхностной энергии отвечает определённым поверхностным явлениям: изменение реакционной способности с изменением дисперсности; адгезия и смачивание; капиллярность адсорбция; электрическая способность.
В результате адсорбции происходит перераспределение компонентов между объёмными фазами и поверхностным слоем, что влечёт за собой изменение их химических потенциалов в системе, поэтому этот процесс можно рассматривать как превращение поверхностной энергии в химическую.
При адсорбционных процессах снижение свободной поверхностной энергии 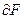 связано с изменением внутренней энергии
связано с изменением внутренней энергии 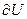 . Таким образом, объединённое уравнение I и II начала термодинамики для внутренней энергии поверхности с учётом поверхностей и их химической энергии имеет вид:
. Таким образом, объединённое уравнение I и II начала термодинамики для внутренней энергии поверхности с учётом поверхностей и их химической энергии имеет вид:
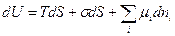
т.к. внутренняя энергия поверхности пропорциональна 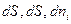 , то:
, то:
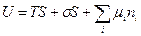
при дифференцировании этого уравнения получаем:
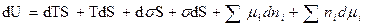
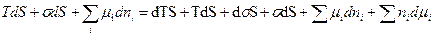 =>
=> 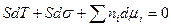
при Т = const: 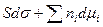 = 0 – уравнение Гиббса для межфазовой поверхности
= 0 – уравнение Гиббса для межфазовой поверхности
Т.к. внутренняя энергия, энтропия, число молей зависят от площади, то разделим уравнение Гиббса для межфазной поверхности на площадь:

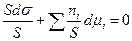 ,
,  =>
=>
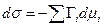 - фундаментальное уравнение адсорбции Гиббса
- фундаментальное уравнение адсорбции Гиббса
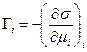
Для разбавленных растворов 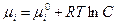 , где
, где 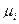 и
и 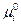 - равновесный и стандартный химические потенциалы адсорбата I соответственно, С – концентрация адсорбата, R – универсальная газовая постоянная (8,314 Дж/моль∙К).
- равновесный и стандартный химические потенциалы адсорбата I соответственно, С – концентрация адсорбата, R – универсальная газовая постоянная (8,314 Дж/моль∙К).
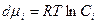
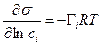

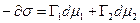 ,
,
где 1 – растворитель, 2 – растворенное вещество.
Для разбавленного раствора химический потенциал изменяется очень слабо 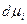 = 0.
= 0.
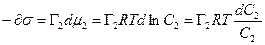
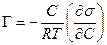 - уравнение изотермы Гиббса
- уравнение изотермы Гиббса
Дата добавления: 2015-08-11; просмотров: 2231;
