Связь адсорбции и поверхностного натяжения
Поверхностное натяжение зависит от природы растворителя и растворённого вещества, концентрации растворенного вещества и температуры.
Зависимость поверхностного натяжения растворов при постоянной температуре от концентрации растворённого вещества называют изотермой поверхностного натяжения. Растворённые вещества могут изменять поверхностное натяжение растворителя следующим образом:
- уменьшают поверхностное натяжение чистого растворителя σ0 и в таком случае их называют ПАВ;
- повышают поверхностное натяжение чистого растворителя σ0 и в таком случае они являются поверхностно инактивными веществами ПИАВ;
- не влияют на поверхностное натяжение чистого растворителя σ0.
В водных растворах ПАВ – это полярные органические соединения (спирты, кислоты, амины, фенолы). ПАВ делятся на: истинно растворимые в воде (дифильные молекулы с короткими углеводородными радикалами) и мицеллярные коллоиды (дифильные молекулы с длинными углеводородными радикалами, малорастворимые в воде).
ПИАВ – сильные электролиты.
Если σ0 – поверхностное натяжение чистого растворителя, а σ – растворенного вещества, то
а) σ0 < σ и σ0 > σр.в. для ПАВ;
б) σ0 > σ и σ0 < σр.в для ПИАВ.
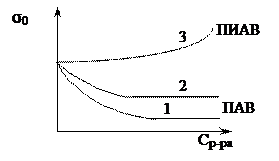 |
Рис. 7. Изотермы поверхностного натяжения растворов: 1 и 2 – раствор ПАВ с большей и меньшей активностью соответственно; 3 – раствор ПИАВ.
Разность концентраций растворенного вещества в поверхностном слое и в таком же слое внутри объёма раствора, отнесенным к единице площади поверхности или единице массы адсорбента, называется поверхностным избытком этого вещества (Гиббсовская адсорбция) – Г.
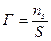 ,
,
где 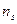 – число молей адсорбата, приходящегося на разделенную поверхность.
– число молей адсорбата, приходящегося на разделенную поверхность.
Рассмотрим адсорбцию на поверхности раздела раствор – воздух. Молекулы спиртов (ROH) в поверхностном слое раствора самопроизвольно ориентированы таким образом, что неполярная углеводородная часть радикала выходит из воды в соседнюю неполярную фазу (воздух), а полярная гдрофильная группа –ОН взаимодействует с водой и остается в водной фазе. Такая ориентация и обеспечивает снижение свободной поверхностной энергии раствора и поверхностного натяжения. С увеличением общей концентрации раствора величина адсорбции растёт и молекулы ПАВ в адсорбированном слое сближаются и в пределе (когда концентрация стремится к бесконечности) образуют плотно упакованный монослой – частокол Ленгмюра.
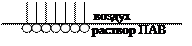 |
Рис. 8. Схема ориентации дифильных молекул на границе раздела фаз.
Величина поверхностного натяжения при этом снижается до минимального значения, а адсорбция достигает предельной величины. Энергия ВДВ взаимодействия углеводородного радикала с полярными молекулами воды меньше, чем энергия взаимодействия молекул воды между собой, следовательно, на границе раздела водный раствор/воздух радикалы R самопроизвольно переходят в соседнюю фазу, что является энергетически выгодно и обнаруживается как уменьшение поверхностного натяжения (поверхностной энергии).
Поскольку наличие молекул ПАВ в поверхностном слое энергетически выгодно 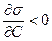 , то происходит самопроизвольное концентрирование растворённого вещества на межфазной границе.
, то происходит самопроизвольное концентрирование растворённого вещества на межфазной границе.
Мерой активности ПАВ является способность его к понижению поверхностного натяжения:
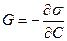
Высокая поверхностная активность коллоидных ПАВ зависит главным образом от длины углеводородного радикала. Увеличение радикала на одну СН2 группу приводит к возрастанию поверхностной активности приблизительно в 3,2 раза.
Дата добавления: 2015-08-11; просмотров: 2131;
