Химическая кинетика И катализ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ 2 страница
Таким образом, в растворах электролитов имеет место гидратация и сольватация (Менделеев) и электролитическая диссоциация (Аррениус) как два единых процесса растворения электролитов в растворе («две стороны одной медали»), что и ввел в теорию и практику Каблуков.
Электролитическая диссоциация вызывается взаимодействием полярных молекул растворителя с частицами растворяемого вещества. Это взаимодействие приводит к поляризации связей. Происходит образование ионов за счет «ослабления» и разрыва связей в молекулах растворяемого вещества. Переход ионов в раствор сопровождается их гидратацией:
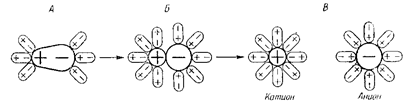
Рис. 11.1. Схема процессов гидратации и диссоциации полярной молекулы электролита типа HCl (разрыв ионогенной полярной ковалентной связи с ее переходом в ионную связь).
Кратко остановимся на водных растворах электролитов, основными участниками которых являются вода, кислоты, щелочи, соли и образуемые ими гидраты ионов (аквакомплексы), комплексные соединения.
Особенностью водных растворов электролитов является ион водорода (протон), имеющий малый размер (10–4 от размера атома), и образующий при гидратации ион гидроксония – Н3О+. Новая ковалентная связь образуется по донорно-акцепторному механизму за счет свободной электронной пары кислорода (донора) и вакантной орбитали протона (акцептора).
Характер ионов, образующихся при диссоциации различных электролитов, естественно, должен быть различным. В молекулах солей диссоциация всегда приводит к образованию катионов металла и анионов кислотного остатка. Кислотами являются электролиты, которые диссоциируют с образованием ионов Н+. Сильные кислоты (HCl, HBr, HI, HNO3, H2SO4) диссоциируют практически полностью, у слабых кислот диссоциирована лишь часть молекул. Основание определяют как электролит, диссоциирующий с образованием ионов ОН–. Сильные основания (NaOH, KOH) диссоциируют практически полностью, у слабых электролитов диссоциирована лишь некоторая доля молекул.
Существуют электролиты, которые могут диссоциировать как кислоты и как основания. Такие электролиты называются амфотерными электролитами (амфолитами). Амфотерность электролитов объясняется малым различием прочности связей Me–O и H–O. Примером амфотерного электролита может быть гидроксид цинка:
2H++ZnO22– ⇄ H++HZnO2– ⇄ Zn(OH)2 ⇄ZnOH++OH– ⇄Zn2++2OH–
При взаимодействии с азотной кислотой
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
при взаимодействии с гидроксидом калия
Zn(OH)2 + 2KOH = K2ZnO2 + 2H2O
В растворах слабых электролитов процесс диссоциации протекает обратимо и, следовательно, к нему может быть применен закон действия масс, например:
CH3COOH ⇄ CH3COO–+ H+
Константа равновесия Kp будет равна:
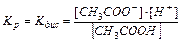 (11.3).
(11.3).
Константа равновесия для процесса диссоциации называется константой диссоциации Kдис.
Установлено, что многоосновные кислоты отщепляют ион водорода не сразу, а постепенно. Например,
1) H3PO4 ⇄ H++H2PO4– K1=7,11×10–3
2) H2PO4 ⇄ H++HPO42– K2=6,34×10–8
3) HPO4 ⇄ H++PO43– K3=1,26×10–12
Каждая ступень характеризуется своей константой диссоциации, но первая ступень идет легче, поэтому К1 больше следующей и т.д.
Константа диссоциации представляет собой важную характеристику слабых электролитов, так как указывает на прочность их молекул в данном растворе. Чем меньше константа диссоциации в данном растворителе, тем слабее диссоциирует электролит и тем устойчивее его молекулы.
Константа электролитической диссоциации зависит лишь от природы электролита и температуры. Между константой и степенью электролитической диссоциации существует количественная связь. Действительно, пусть в рассмотренном процессе общая концентрация растворенного вещества КА равна C, а степень диссоциации равна a. Тогда [K+] = [A–] = a×C и соответственно концентрация недиссоциированных частиц [KA] = (1–a)×C. Подставив эти значения в выражение для константы диссоциации, получим известный закон разбавления Оствальда:
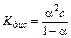 (11.4)
(11.4)
Это соотношение называется законом разбавления Оствальда. Для слабых электролитов, когда a <<1, Кдис ≈ a2C. Отсюда
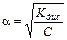 или
или 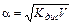 , (11.5)
, (11.5)
где V=1/C – разбавление. Из формулы следует, что при разбавлении раствора в 100 раз степень диссоциации возрастет в 10 раз.
Электропроводность растворов электролитов зависит от их концентраций в растворе. Величина, характеризующая данный раствор, называется удельной электропроводностью c
c = 1 / r (11.6)
где r– удельное электрическое сопротивление.
С разбавлением раствора она уменьшается, вследствие уменьшения концентрации, но в тоже время увеличивается степень диссоциации.
§ 2. Сильные электролиты. Активность.Согласно теории диссоциации, сильные электролиты практически полностью диссоциируют не только в разбавленных растворах, но и в растворах любой концентрации. Другими словами, в любых растворах сильных электролитов степень их диссоциации a =1 (100%).
Таким образом, считается, что в растворах сильных электролитов нет недиссоциированных молекул, поэтому понятие константы диссоциации к ним не применимо (знаменатель выражения вида (11.3) равен нулю).
При определенных условиях, например, когда растворитель обладает малой диэлектрической проницаемостью, создаются условия для электростатического взаимодействия сольватированных ионов противоположного знака. При этом последние подходят друг к другу на близкое расстояние и образуют так называемую ионную пару – сложный агрегат, состоящий из двух противоположно заряженных ионов, окруженных молекулами растворителя, в котором электрические заряды взаимно компенсированы.
При повышении концентрации раствора расстояния между ионами сокращаются, что усиливает межионное взаимодействие. Вследствие этого экспериментально определяемые свойства растворов сильных электролитов, зависящие от общего количества частиц в растворе, оказываются меньше рассчитанных в предположении полной диссоциации.
Чтобы можно было пользоваться простыми соотношениями идеальных растворов для описания поведения реальных растворов, Льюис (1907) ввел формальное представление об эффективной концентрации – активности. Активность связана с истинной концентрацией растворенного вещества соотношением
a = f×C, (11.7)
где a – активность, f – коэффициент активности, C – концентрация.
Активность выражается в тех же единицах, что и концентрация, поскольку коэффициент активности – величина безразмерная. Он характеризует степень отклонения свойств данного раствора от свойств идеального раствора. Для бесконечно разбавленных растворов электролитов, где практически отсутствует взаимодействие ионов, активность становится равной концентрации и коэффициент активности равен единице.
Так как коэффициенты активности учитывают также степень диссоциации электролита в растворе, их применяют и при описании свойств растворов слабых электролитов. Коэффициенты активности вычисляют по экспериментальным данным. Для этого измеряют какое-либо из свойств раствора (например, электропроводность, температуру кипения или замерзания) и определяют коэффициент активности как частное от деления экспериментально полученной величины на теоретически рассчитанную по законам идеальных растворов:
Таблица 11.1
Коэффициенты активности некоторых электролитов в растворах при 298 К
| Концентрация, | f ± для электролитов | ||||||
| NaCl | KCl | NaOH | KOH | HCl | H2SO4 | CaCl2 | |
| 0,001 0,01 0,1 0,5 1,0 2,0 5,0 | 0,965 0,874 0,778 0,681 0,657 0,668 0,874 | 0,966 0,901 0,769 0,651 0,607 0,576 — | 0,966 0,900 0,776 0,693 0,679 0,700 1,060 | 0,966 0,900 0,766 0,712 0,735 0,863 1,670 | 0,966 0,904 0,796 0,758 0,809 1,010 2,380 | 0,830 0,544 0,265 0,156 0,132 0,128 0,208 | 0,840 0,850 0,518 0,448 0,500 0,792 0,890 |
В области разбавленных растворов (ниже 0,1 моль/л) коэффициенты активности зависят главным образом от концентрации и заряда ионов, присутствующих в растворе, и мало зависят от природы растворенных веществ. Эта закономерность известна в теории растворов под названием «правила ионной силы», учитывающее электростатическое взаимодействие ионов и диполей. Согласно этому правилу ионы одинакового заряда независимо от их природы в разбавленных растворах с одинаковой ионной силой имеют равные коэффициенты активности. Ионной силой раствора (I) называется полусумма произведений концентрации всех ионов, на квадрат их заряда (z):
 (11.8)
(11.8)
где i – порядковый номер иона.
3. Водородный показатель. Индикаторы. Вода служит не только наиболее распространенным растворителем для многих электролитов, но и сама является идеальным амфолитом. В соответствии с равновесием
H2O ⇄ H+ + OH–
в чистой воде присутствуют катионы водорода и гидроксид-анионы в строго эквивалентных количествах. Константа диссоциации воды
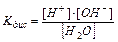 (11.9)
(11.9)
имеет значение в стандартных условиях – 1,8×10–16 т.е. вода диссоциирована в очень малой степени. Так как вода – очень слабый электролит, то концентрация недиссоциированных молекул может быть принята равной общему количеству молей в 1 л воды, т.е. [Н2O] = 1000/18 = 55,56 моль/л. Тогда Kдис×[H2O] = [H+]×[OH–] или [H+]×[OH–] = 1,8×10–16× 55,56 = 10–14 (константа воды).
Величина[H+]×[OH–] = 10–14 называется ионным произведением воды – 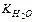 , Kw. Так как в воде концентрации гидратированных ионов равны, то [H+] = [OH–] =
, Kw. Так как в воде концентрации гидратированных ионов равны, то [H+] = [OH–] = 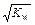 = 10–7 моль/л.
= 10–7 моль/л.
Константа равновесия Kw увеличивается с ростом температуры. При добавлении кислоты концентрация ионов водорода увеличивается и соответственно уменьшается концентрация гидроксид-ионов, поскольку при данной температуре ионное произведение воды – величина постоянная. При добавлении щелочи наблюдается обратная картина. Таким образом, концентрация ионов водорода в растворе может служить мерой кислотности или щелочности среды. В кислых растворах [H+] > 10–7, в щелочных [H+] < 10–7. Вводится значение десятичного логарифма концентрации водородных ионов с обратным знаком, которое называют водородным показателем pH:
pH = –lg[H+] (11.10)
Тогда для нейтральной среды pH = 7, для кислых растворов рН < 7, а для щелочных рН > 7. Аналогичным образом реакция среды может быть охарактеризована так называемым гидроксильным показателем:
pOH = –lg[OH–](11.11)
Для воды рН = рОН = 7, а изменение рОН в кислых и щелочных растворах противоположно изменению рН. Прологарифмировав ионное произведение воды, получим
lg[H+] + lg[OH–] = –14 (11.12)
Взяв логарифмы со знаком «–» , получим соотношение рН+рОН=14, Водородный показатель удобно представить в виде шкалы (рис. 11.2).
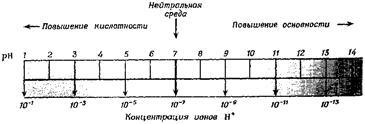
Рис. 11.2. Шкала pH.
Для определения рН используют так называемые кислотно-основные индикаторы – вещества, меняющие свой цвет в зависимости от относительной концентрации ионов H+ и ОН–. Индикаторы представляют собой слабые органические кислоты или основания. Одним из наиболее известных индикаторов является лакмус, окрашивающийся при избытке Н+ (т.е. в кислой среде) в красный цвет, при избытке ОН– (т.е. в щелочной среде) – в синий и имеющий в нейтральной среде фиолетовую окраску за счет равновесия: HInd ⇄ H+ + Ind–.
§ 4. Гидролиз. Равновесие с участием малорастворимых веществ. Наряду с электролитической диссоциацией и гидратацией (напомним, что это процесс взаимодействия ионов с молекулами воды за счет донорно-акцепторных связей, как правило, с образованием гидратированных ионов) имеется еще реакция гидролиза («разложения» водой). Гидролизом называется обменная реакция разложения соли водой, в результате которой получаются слабые кислоты или основания. Реакция гидролиза обратна реакции нейтрализации
Рассмотрим важнейшие случаи гидролиза солей.
1) Соль слабой кислоты и сильного основания. Сюда относятся такие соли как Na2CO3, K2CO3, CH3COONa, KCN и т.д.
Na2CO3 + HOH ⇄ NaHCO3 + NaOH
CO32– + HOH ⇄ HCO3–+ OH–
KOH сильное основание, хорошо диссоциируется в водном растворе, а CH3COOH – слабая кислота, распадающаяся на ионы лишь в очень малой степени. Раствор приобретает щелочную реакцию, вследствие наличия в нем свободных гидроксильных ионов в концентрации, более высокой, чем H+ ионов
[OH–]>[H+], pH>7.
2) Соль слабого основания и сильной кислоты. Сюда относятся NH4Cl, NH4NO3, AlCl3, CuSO4 и т.д.
NH4NO3 + HOH ⇄NH4OH + HNO3
NH4+ + HOH ⇄ NH4OH + H+
NH4OH – слабое основание, малодиссоциирующее, HNO3 – сильная кислота, сильнодиссоциирующая. [H+]>[OH–], pH < 7.
3) Соль образованная слабым основанием и слабой кислотой. Сюда относятся NH4CN, Al2S3,(CH3COO)3Fe
NH4CN + HOH ⇄ NH4OH+HCN
Раствор приобретает слабокислую, если кислота сильнее основания или слабощелочную, если основание сильнее кислоты, реакцию.
4) Соль, образованная сильным основанием и сильной кислотой. Она не гидролизуется, т.к. обратная гидролизу реакция нейтрализации практически необратима, т.е. протекает да конца.
Показателем глубины протекания процесса гидролиза служит степень гидролиза
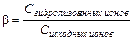 (11.13)
(11.13)
Гидролиз соли, образованной слабой кислотой HA и сильным основанием, характеризуется константой гидролиза KГ:
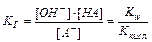 (11.14)
(11.14)
Kw – ионное произведение воды.
Аналогично для соли слабого основания MOH и сильной кислоты:
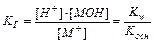 (11.15)
(11.15)
Произведение растворимости. В насыщенном растворе малорастворимого сильного электролита устанавливается равновесие между осадком (тв. фазой) электролита и ионами электролита в растворе, например:
BaSO4 (тв.) ⇄Ba2+ (р-р) + SO42– (р-р)
Т.к. в растворах электролитов состояние ионов определяется их активностями, то константа равновесия процесса выразится уравнением
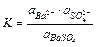 (11.16)
(11.16)
Активность сульфата бария является при данной температуре константой. Следовательно, произведение активностей ионов Ba2+ и SO42– представляют собой постоянную величину, называемую произведением растворимости и обозначаемую ПР:
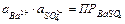 (11.17)
(11.17)
Произведение активностей ионов малорастворимого электролита, содержащихся в его насыщенном растворе (произведение растворимости), есть величина постоянная при данной температуре.
Если электролит очень мало растворим, то ионная сила его насыщенного раствора близка к нулю, а коэффициент активности ионов мало отличается от единицы. В подобных случаях произведение активностей ионов в выражении можно заменить произведением их концентраций
 ,
, 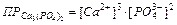
При увеличении концентрации одного из ионов электролита в его насыщенном растворе произведение концентраций ионов электролита становится больше ПР. При этом равновесие между твердой фазой и раствором смещается в сторону образования осадка. Таким образом, условием образования осадка является превышение произведения концентраций ионов малорастворимого электролита над его произведением растворимости.
Если в насыщенном растворе электролита уменьшится концентрация одного из ионов, произведение концентраций ионов будет меньше значения ПР, раствор станет насыщенном, а равновесие между жидкой фазой и осадком смещается в сторону растворения осадка. Следовательно, растворение осадка малорастворимого электролита происходит при условии, что произведения концентраций его ионов меньше значения ПР.
§ 5. Структура воды. Водородная связь.Промежуточный характер между валентным и межмолекулярным взаимодействием имеет так называемая водородная связь. Она осуществляется между положительно заряженным протоном (поляризованным атомом водорода), химически связанным в одной молекуле, и отрицательно заряженным ионом гетероатома (поляризованным атомом фтора, кислорода, азота или хлора), принадлежащим другой молекуле. То, что подобное взаимодействие не обнаруживается у других атомов, обусловлено уникальными свойствами поляризованного атома водорода, протона – его малым размером и отсутствием электронов. Водородная связь проявляется тем сильнее, чем больше относительная электроотрицательность и меньше размер атома-партнера.
Благодаря наличию водородной связи молекулы объединяются в димеры и более сложные ассоциаты, устойчивые в растворах. Ассоциаты (или кластеры) – многомолекулярные образования могут представлять собой одномерные образования, двумерные плоские сетки и трехмерные пространственные структуры.
В кристалле льда молекулы воды расположены тетраэдрически. Каждый атом кислорода тетраэдрически связан с четырьмя атомами водорода. Создается ажурная структура, далекая от плотной упаковки. При плавлении льда водородные связи частично разрушаются. Это сближает молекулы, поэтому вода плотнее льда.
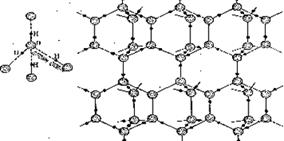
| Рис. 11.3. Структура льда с водородными связями. |
Силы, обеспечивающие возможность существования жидкой фазы, носят различный характер. Чаще всего это межмолекулярные ван-дер-ваальсовые силы взаимодействия типа диполь-диполь или диполь-индуцированный диполь, либо дисперсионные, описанные Лондоном и называемые силами взаимодействия Ван-дер-Ваальса - Лондона. Энергия последних сильно зависит от расстояния между центрами взаимодействующих частиц (она пропорциональна 1/r6), поэтому такие взаимодействия могут возникать только на очень коротких расстояниях. Энергия межмолекулярных взаимодействий, как правило, на 2-3 порядка меньше энергии обычных химических связей (2-20 кДж/моль).
Одним из интересных типов межмолекулярного взаимодействия является водородная связь, наиболее ярко и своеобразно проявляющаяся в жидкой воде, придающая особый облик ее структуре и химическим свойствам. Именно наличием водородной связи обусловлены свойства воды как универсального растворителя.
В системах с наиболее прочными водородными связями межъядерные расстояния O-Н и Н-O во фрагменте O-Н...О выравниваются. Самая короткая водородная связь обнаружена в анионе НF2–, здесь она симметрична и имеет энергию связи порядка 155-242 кДж.
Еще одним примером проявления сильной водородной связи является катион Н5О2+(напомним существование Н3О+), реализующиеся в воде в форме димера [Н2О-Н-ОН2]+, существующий в воде при определенных значениях рН. В линейном фрагменте О-Н-О реализуется водородная связь, расстояние О-О равно 0,25 нм, расстояние O-Н – 0,125 нм, энергия связи примерно 150 кДж. На этом примере можно видеть, как в результате образования Н-связей резко сокращается расстояние между взаимодействующими частицами по сравнению с обычным межмолекулярным взаимодействием. Для ассоциатов, кластеров с большим числом молекул воды водородная связь приобретает ассиметричный характер: фрагмент О-Н-О длиной 0,36 нм имеет два неравных плеча О-Н – 0,1 и 0,26 нм.
Например, в структуре льда между атомами кислорода во фрагменте O-Н...О расстояние О...О составляет 0,276 нм, что заметно отличается от 0,36 нм, однако больше, чем 0,25 нм, характерного для очень сильной водородной связи.
Какова же природа водородной связи? Долгое время ее описывали как не совсем обычное электростатическое взаимодействие.
Более глубокое проникновение в природу взаимодействий показало несостоятельность электростатического подхода. Основой электростатического взаимодействия прежде всего является ее ненаправленный характер. Поэтому появление водородной связи следовало ожидать в любом пространственном расположении двух взаимодействующих молекул. Однако опыт показывает, что водородная связь имеет строго направленный характер. И, наконец, при электростатическом подходе невозможно объяснить перераспределение валентной электронной плотности при взаимодействии молекул, которое играет существенную роль при образовании водородной связи.
Полные квантовомеханические расчеты показывают, что в линейном фрагменте О-Н···О происходит общий сдвиг валентной электронной плотности от одного кислорода к другому.
Таким образом, по своей природе водородная связь является разновидностью донорно-акцепторной связи. Особенность ее заключается в том, что электронная пара атома О молекулы Н2О непосредственно взаимодействует с атомом Н группы О-Н, через которую и осуществляется перенос заряда на другую молекулу воды. В результате такого взаимодействия происходит увеличение дипольного момента комплекса с водородной связью по сравнению с геометрической суммой дипольных моментов изолированных молекул воды. Так, эффективный дипольный момент молекул воды, связанных водородными связями, равен 2,60 Д, а свободных молекул воды – 1,85 Д.
Чем больше молекул вовлекается в образование комплекса с водородными связями, тем в большей степени происходит перераспределение электронного заряда, тем сильнее водородные связи и выше их энергия. Это означает, что в жидких системах водородные связи носят кооперативный характер, они пронизывают всю жидкую систему, вовлекая в такое взаимодействие огромное число молекул.
Итак, водородная связь есть особый вид межмолекулярного донорно-акцепторного взаимодействия, в котором принимают участие все атомы, входящие в состав молекул. Это взаимодействие носит характер направленного дрейфа электронной плотности от молекулы-донора к молекуле-акцептору. Специфика водородной связи связана с уникальной электронной структурой атома водорода, поскольку в этом случае атом молекулы-донора со своей неподеленной электронной парой может приблизиться на очень короткое расстояние к атому Н, входящему в состав молекулы акцептора. Уникальность электронной структуры атома водорода заключается в отсутствии у него заполненных электронных оболочек. Специфика водородной связи в воде и водных растворах можно охарактеризовать двумя терминами: эстафетность и динамичность, т.е. протоны обеспечивают структурную организацию кластеров за счет большой скорости «эстафетного» переноса электронной плотности. Уместно сравнить явление с «бегущей волной» зрителей на стадионе, тем самым, подчеркивая волновой характер делокализованной химической связи для большого ансамбля числа молекул.
Более детально свойства водных растворов электролитов рассмотрены в дополнении к лекции 12.
Лекция 13
Окислительно-восстановительные реакции
Другим важным типом химических реакций, протекающих, как правило, в водных растворах, являются окислительно-восстановительные реакции или реакции с переносом электрона, в которых одни реагенты теряют, а другие приобретают электроны, меняют степень окисления.
§ 1. Степень окисления. Одним из основных понятий в химии, широко использующимся при составлении уравнений ОВР, является степень окисления (с.о.)атомов.
С.о. атома (элемента) в соединении – это условный заряд, вычисленный в предположении, что соединение состоит только из ионов. При определении с.о. условно предполагают, что валентные электроны в соединении переходят к более электроотрицательным атомам, а потому соединения состоят из положительно и отрицательно заряженных ионов. В действительности же в большинстве случаев происходит не полная отдача электронов, а только смещение электронной пары от одного атома к другому. Тогда можно дать другое определение: Степень окисления – это тот электрический заряд, который возник бы на атоме, если бы электронные пары, которыми он связан с другими атомами в соединении, перешли к более электроотрицательным атомам, а электронные пары, связывающие одинаковые атомы, были бы между ними поделены.
При вычислении степеней окисления используется ряд простых правил. С.о. простых веществ, как одноатомных, так и молекулярных, равна 0 (Fe0, O 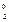 ). С.о. любого простого одноатомного иона равна заряду этого иона (Na+1, Ca+1, S–2). С.о. водорода в соединениях равна +1 (
). С.о. любого простого одноатомного иона равна заряду этого иона (Na+1, Ca+1, S–2). С.о. водорода в соединениях равна +1 ( 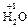 ,
, 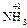 ), за исключением гидридов металлов, где она равна -1 (
), за исключением гидридов металлов, где она равна -1 ( 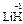 ,
, 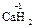 ). С.о. кислорода в соединениях равна -2 (
). С.о. кислорода в соединениях равна -2 ( 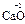 ,
, 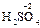 ); за исключением пероксидов, где она формально равна -1 (
); за исключением пероксидов, где она формально равна -1 ( 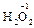 ), и фторида кислорода, где она равна +2 (
), и фторида кислорода, где она равна +2 ( 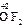 ). С.о. фтора в соединениях всегда равна -1, с.о. других галогенов (Cl, Br, I) равна -1, за исключением соединений с более электроотрицательными элементами, в которых она принимает положительные значения от +1 до +7 (
). С.о. фтора в соединениях всегда равна -1, с.о. других галогенов (Cl, Br, I) равна -1, за исключением соединений с более электроотрицательными элементами, в которых она принимает положительные значения от +1 до +7 ( 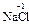 ,
, 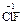 ,
, 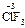 ).
).
В ковалентных соединениях неметаллов более электроотрицательному элементу приписывается отрицательная с.о., равная заряду его наиболее распространенного аниона. Например, в CCl4 с.о. хлора -1, а углерода +4; в SF6 с.о. F
-1, а серы +6; но в CS2 с.о. серы -2, тогда с.о. углерода +4.
Алгебраическая сумма с.о. в нейтральной молекуле равна нулю, в комплексном ионе – заряду иона. Например, в NH4Cl сумма с.о. всех атомов водорода равна 4×(+1), а с.о. хлора -1, следовательно, с.о. азота должна быть -3. В сульфат-ионе SO42– сумма с.о. четырех атомов кислорода равна -8, поэтому сера должна иметь с.о. +6, чтобы полный заряд иона был равен -2. В химических реакциях должно выполняться правило сохранения алгебраической суммы с.о. всех атомов. В полном уравнении химической реакции окислительные и восстановительные процессы должны точно компенсировать друг друга.
Дата добавления: 2015-08-11; просмотров: 653;
