Классификация термодинамических процессов
| Процесс | Условия |
| Изотермический | Постоянная температура – T = const |
| Изобарный | Постоянное давление – p = const |
| Изохорный | Постоянный объем – V = const |
| Адиабатический | Отсутствие теплообмена между системой и внешней средой – dQ=0 |
Первое начало термодинамики, или закон сохранения энергии, гласит, что энергия не может возникать из ничего и исчезать, а только переходит из одной формы в другую. Например, внутренняя энергия, содержащаяся в веществе, может превращаться в тепловую, световую (пламя), электрическую (химический аккумулятор) и т.д.
Например, сообщим системе некоторое количество тепловой энергии Q, котораярасходуется на совершение работы A и на изменение состояния внутренней энергии системы DU:
Q = A + DU (7.1),
где DU – изменение величины, которую называют внутренней энергией системы. Если система совершает работу за счет внутренней энергии без поступления теплоты, то A = –DU (адиабатический процесс).
Таким образом, увеличению внутренней энергии системы соответствуют положительные значения DU, уменьшению – отрицательные значения. Теплота, сообщаемая системе, и работа, совершаемая системой, также считаются
положительными, и наоборот, теплота, отдаваемая системой, и работа, совершаемая над системой, считаются отрицательными.
Внутренняя энергия относится к функциям состояния, т.е. величинам, которые зависят только от состояния системы и не зависят от ее предыстории. Следовательно, изменение внутренней энергии в ходе процесса зависит только от начального и конечного состояния и не зависит от пути протекания процесса. Напротив, работа зависит от пути протекания процесса, и поэтому не обладает свойствами функции состояния, как «запас работы», которую может совершить система.
Единицей измерения работы, теплоты и внутренней энергии в системе СИ служит джоуль (Дж). 1 джоуль – это работа силы в 1 ньютон на расстоянии 1 м (1 Дж = 1 Н×м = 1 кг×м2/с2). В старой химической литературе широко использовалась единица количества теплоты и энергии калория (кал). 1 Калория – это такое количество теплоты, которое необходимо для нагревания 1 г воды на 1°C. 1 Кал = 4,184 Дж » 4,2 Дж. Теплоты химических реакций удобнее выражать в кило-джоулях или килокалориях: 1 кДж = 1000 Дж, 1 ккал = 1000 кал.
§ 3. Закон Гесса. В химической термодинамике первый закон трансформируется в закон Гесса,характеризующий тепловые эффекты химических реакций.Теплота, как и работа, не является функцией состояния. Поэтому для придания тепловому эффекту свойства функции состояния введена энтальпия (DH), направленное изменение которой составляет DH = DU+PDV при постоянном давлении. Отметим при этом, что PDV = A – работе расширения, а DH = –Q (с обратным знаком). Энтальпию характеризуют теплосодержанием системы так, что экзотермическая реакция понижает DH. Обратите внимание, что выделению теплоты в химической реакции (экзотермической) соответствует DH < 0, а поглощению (эндотермической) DH > 0. В старой химической литературе была принята противоположная система знаков (!) (Q > 0 для экзотермических реакций и Q < 0 для эндотермических).
Изменение энтальпии (тепловой эффект) не зависит от пути реакции, а определяется только свойствами реагентов и продуктов (закон Гесса, 1836)
Покажем это на следующем примере:
C(графит) + O2(г.) = CO2(г.) DH1 = –393,5 кДж
С(графит) + 1/2 O2(г.) = CO(г.) DH2 = –110,5 кДж
СО(г.) + 1/2 O2(г.) = СО2(г.) DH3 = –283,0 кДж
Здесь энтальпия образования CO2 не зависит от того, протекает ли реакция в одну стадию или в две, с промежуточным образованием CO (DH1 = DH2 + DH3). Или иными словами сумма энтальпий химических реакций в цикле равна нулю:
rot 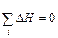 (7.2),
(7.2),
где i – число реакций в замкнутом цикле.
В любом процессе, когда конечное и начальное состояния веществ одинаковы, сумма всех теплот реакции равна нулю.
Например, мы имеем последовательность из нескольких химических процессов, приводящих в конце к исходному веществу и характеризующихся каждый своей энтальпией, т.е.
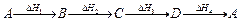 (7.3)
(7.3)
то, согласно закону Гесса,
DH1 + DH2 + DH3 + DH4 = 0 (7.4)
Результирующий тепловой эффект равен нулю потому, что на одних стадиях тепло выделяется, на других – поглощается, что приводит к взаимной компенсации.
Закон Гесса позволяет вычислить тепловые эффекты тех реакций, для которых прямое измерение невозможно. Например, рассмотрим реакцию:
H2(г.) + O2(г.) = H2O2(ж.) DH1 = ?
Экспериментально легко измерить следующие тепловые эффекты:
H2(г.) + 1/2O2(г.) = H2O(ж.) DH2 = –285,8 кДж
H2O2(ж.) = H2O(ж.) + 1/2O2(г.) DH3 = –98,2 кДж
Пользуясь этими значениями, можно получить:
DH1 = DH2 – DH3 = –285,8 + 98,2 = –187,6 (кДж/моль).
Таким образом, достаточно измерить тепловые эффекты ограниченного числа реакций, чтобы затем теоретически вычислить тепловой эффект любой реакции. На практике табулированы стандартные энтальпии образования DHf°298, измеренные при Т=298,15 К (25°C) и давлении p = 101,325 кПа (1 атм), т.е. при стандартных условиях. (Не путать стандартные условия с нормальными!)
Стандартная энтальпия образования DHf° – это изменение энтальпии в ходе реакции образования 1 моля вещества из простых веществ:
Ca (тв.) + C (графит) + 3/2O2 (г.) = CaCO3 (тв.) DH°298=–1207 кДж/моль.
Обратите внимание, что в термохимическом уравнении указываются агрегатные состояния веществ. Это очень важно, т.к. переходы между агрегатными состояниями (фазовые переходы) сопровождаются выделением или поглощением тепла:
H2 (г.) + 1/2O2 (г.) = H2O (ж.) DH°298 = –285,8 кДж/моль,
H2 (г.) + 1/2O2 (г.) = H2O (г.) DH°298 = –241,8 кДж/моль.
H2O (г.) = H2O (ж.) DH°298 = –44,0 кДж/моль.
Стандартные энтальпии образования простых веществ приняты равными нулю. Если простое вещество может существовать в виде нескольких аллотропных модификаций, то DH° = 0 приписывается самой устойчивой при стандартных условиях форме, например, кислороду, а не озону, графиту, а не алмазу:
3/2O2 (г.) = O3 (г.) DH°298 = 142 кДж/моль,
C (графит) = C (алмаз) DH°298 = 1,90 кДж/моль.
Следствием закона Гесса с учетом изложенного тогда изменение энтальпии в ходе реакции, будет равно сумме энтальпий образования продуктов за вычетом суммы энтальпий образования реагентов с учетом стехиометрических коэффициентов реакции:
DH(реакции) = SDHf(продуктов) – SDHf(реагентов) (7.5)
Вычислим стандартную энтальпию реакции:
4Al (тв.) + 3PbO2 (тв.) = 2Al2O3 (тв.) + 3Pb (тв.) (a)
Стандартные энтальпии образования найдем по справочным данным:
2Al (тв.) + 3/2O2 (г.) = Al2O3(тв.) DH°298 = –1669,8 кДж/моль, (b)
Pb (тв.) + O2 (г.) = PbO2 (тв.) DH°298 = –276,6 кДж/моль. (c)
С термохимическими уравнениями можно обращаться так же, как и с алгебраическими: умножать на число, складывать, вычитать, переносить слагаемые из одной части в другую.
4Al (тв.) + 3O2 (г.) + 3Pb (тв.) + 3O2 (г.) = 2Al2O3 (тв.) + 3PbO2 (тв.)
DH°298(a) = 2×DH°298(b) – 3×DH°298(c)
4Al (тв.) + 3PbO2 (тв.) = 2Al2O3 (тв.) + 3Pb (тв.)
DH°298(a) = 2×(–1669,8)–3×(–276,6) = –2509,8 кДж.
Обратите внимание, что свободный кислород, не участвующий в реакции, сократился при преобразованиях. На самом деле нет необходимости записывать расчеты так подробно. Если стехиометрические коэффициенты подобраны правильно, то баланс по всем веществам обязательно сойдется. Более кратко расчет DH реакции записывают так:
4Al(тв.) + 3PbO2(тв.) = 2Al2O3(тв.) + 3Pb(тв.)
ΔHf°298 0 3×(–276,6) 2×(–1669,8) 0
DH°298 = 2×(–1669,8)–3×(–276,6) = –2509,8 кДж.
Цикл Борна – Габера. Важным развитием и следствием закона Гесса является установление взаимосвязи между термодинамическими параметрами реакции, химических соединений и энергетическими параметрами атома, молекулы (потенциал ионизации, энергия сродства к электрону, энергия хим. связи, кристаллической решетки и др.). Так, в «Практикуме по общей химии» и в других учебниках дан пример взаимосвязи потенциала ионизации атома натрия (INa), энергий диссоциации молекулы хлора (DHдисс), сублимации (атомизации) натрия (DHат), сродства к электрону (ECl), кристаллической решетки хлорида натрия (U) и собственно энтальпии образования хлорида натрия (DHобр). Так что можно
записать
DHобр = DHат + INa + 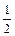 DHдисс + ECl + U (7.6)
DHдисс + ECl + U (7.6)
Ну, а вам останется только построить его графически еще раз.
Рассмотрим возможности цикла Борна – Габера на примере хлоридов (MeCl) и дихлоридов (MeCl2) металлов. Величина U рассчитывается на основе закона Гесса (с использованием старых единиц – ккал).
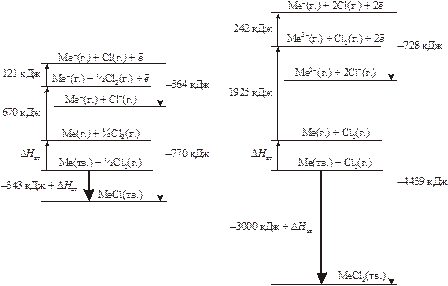
Какие же из хлоридов металлов более термодинамически устойчивы? В обоих случаях общей стадией является атомизация твердого металла с затратой
неизвестного нам, но одинакового количества энергии DHат. Очевидно, не эта величина определяет стабильность обоих хлоридов. Ионизация до двухвалентного состояния требует значительно большего количества энергии, чем однократная ионизация атома. На стадии ионизации хлора в случае MeCl2 также требуется затратить вдвое больше энергии, чем для MeCl. Энергетически выгодна форма MeCl2, а не MeCl. Хотя реакции 1-4 для MeCl и дают выигрыш
242 ккал/моль по сравнению с теми же реакциями для MeCl2, это преимущество полностью теряется на стадии образования кристаллической решетки из ионов. Выигрыш за счет энергии решетки MeCl2 оказывается 877 ккал/моль, что с избытком покрывает энергетические расходы на первых стадиях цикла. Поэтому, если даже соединение MeCl в какой-то момент возникает, то затем самопроизвольно по реакции диспропорционирования
2MeCl (тв.) = MeCl2 (тв.) + Me (тв.)
переходит в дихлорид. Тепловой эффект такого процесса будет равен
DH = –553 – DHат ккал/моль, т.е. очень большой величине, как раз и определяющей самопроизвольное течение реакции. Таким образом, можно без преувеличения сказать, что величина энергии кристаллической решетки определяет химическую или валентную форму ионного соединения.
Энергия кристаллической решетки в рядах однотипных соединений определяет также ряд свойств физико-химического характера, например температуру плавления и твердость.
Таблица 6.3.
Некоторые свойства галогенидов натрия.
| Энергия решетки, ккал/моль | Температура плавления, °С | Твердость, ед. Мооса * | |
| NaF | 3,25 | ||
| NaCl | 2,5 | ||
| NaBr | 2,25 | ||
| NaI | 2,0 |
* За 10 принимается твердость алмаза, за 1 – твердость талька.
Видно, что U и свойства находится в прямой зависимости от радиуса иона. Вам остается графически построить оба цикла и по справочным данным оценить энергетические параметры для хлоридов магния, кальция, бария.
§ 4. Второе начало (второй закон) термодинамики. Энтропия.Выделение тепловой энергии в ходе реакции способствует тому, чтобы она протекала самопроизвольно, т.е. без постороннего вмешательства. Однако имеются и другие самопроизвольные процессы, при которых теплота равна нулю (например, расширение газа в пустоту) или даже поглощается (например, растворение нитрата аммония в воде). Это означает, что помимо энергетического фактора на возможность протекания процессов влияет какой-то другой фактор.
Он называется энтропийным фактором или изменением энтропии. Энтропия S является функцией состояния и определяется степенью беспорядка в системе. Опыт, в том числе повседневный, свидетельствует о том, что беспорядок возникает самопроизвольно, а чтобы привести что-нибудь в упорядоченное состояние, нужно затратить энергию. Это утверждение – одна из формулировок второго начала термодинамики.
Существуют и другие формулировки, например, такая: Теплота не может самопроизвольно переходить от менее нагретого тела к более нагретому (Клаузиус, 1850). Брусок, нагретый с одного конца, со временем принимает одинаковую температуру по всей длине. Однако никогда не наблюдается обратный процесс – равномерно нагретый брусок самопроизвольно не становится более теплым с одного конца и более холодным с другого. Другими словами, процесс теплопроводности необратим. Чтобы отнять тепло у более холодного тела, нужно затратить энергию, например, бытовой холодильник расходует для этого электрическую энергию.
Рассмотрим сосуд, разделенный перегородкой на две части, заполненные различными газами. Если убрать перегородку, то газы перемешаются и никогда не разделятся самопроизвольно снова. Добавим каплю чернил в сосуд с водой. Чернила распределятся по всему объему воды и никогда не соберутся
самопроизвольно в одну каплю. В обоих случаях самопроизвольно протекающие процессы сопровождаются увеличением беспорядка, т.е. возрастанием энтропии (DS > 0). Если мы рассматриваем изолированную систему, внутренняя энергия которой измениться не может, то самопроизвольность процесса в ней определяется только изменением энтропии: В изолированной системе самопроизвольно идут только процессы, сопровождающиеся возрастанием энтропии (Больцман, 1896). Это также одна из формулировок второго начала термодинамики. Наглядно проявление энтропийного фактора можно увидеть в фазовых переходах лед–вода, вода–пар, протекающие при постоянной температуре. Как известно при этом происходит поглощение (ледоход – похолодание) и выделение тепла (ледостав – потепление) так, что
DHГ = DS×T (7.7),
где DHГ – «скрытая» теплота фазового перехода. В фазовых переходах лед–вода–пар – DSл< DSв< DSп, т.е. энтропия возрастает при переходе от твердого тела к жидкости и от жидкости к газу, а ее величина тем больше, чем беспорядочнее движутся молекулы. Таким образом, энтропия отражает структурные отличия одного и того же химического элемента, молекулы, вещества. Например, для той же воды H2O – кристалл, жидкость, пар; для углерода – графит, алмаз, как аллотропные модификации и т.д.
Абсолютное значение энтропии можно оценить с использованием третьего начала термодинамики (постулата Планка), которое утверждает, что энтропия идеального кристалла при 0 К равна нулю lim DS=0 (при T®0).
Единицей измерения энтропии в системе СИ является Дж/К×моль. При этом понятно, что абсолютный нуль температуры недостижим (следствие из второго закона термодинамики), но он имеет важное значение в определении температуры – шкалы Кельвина.
Кроме того, есть еще одна функция состояния вещества – теплоемкость
DС = DH/DT, (7.8)
которая имеет такую же размерность, что и энтропия, но означает способность того или иного вещества отдавать (принимать) тепло при изменении температуры. Например, при изменении температуры на 100°С сталь быстрее нагреется и остывает соответственно, чем кирпич, поэтому печки кладут из кирпича. Величины теплоемкости удельные или молярные табулированы в справочниках обычно для изобарных условий – cp.
Стандартные абсолютные энтропии S°298 образования некоторых веществ приведены в справочной литературе. Обратите внимание, что в отличии от DHf простые вещества имеют значения S°298 > 0, т.к. их атомы и молекулы также находятся в беспорядочном тепловом движении. Чтобы найти изменение энтропии в реакции, можно также применить следствие закона Гесса:
DS(реакции) = SS(продуктов) – SS(реагентов) (7.9)
DS > 0 согласно второму началу термодинамики благоприятствует протеканию реакции, DS < 0 — препятствует.
Качественно можно оценить знак DS реакции по агрегатным состояниям реагентов и продуктов. DS > 0 для плавления твердых тел и испарения жидкостей, растворения кристаллов, расширения газов, химических реакций, приводящих к увеличению числа молекул, особенно молекул в газообразном состоянии. DS < 0 для сжатия и конденсации газов, затвердевания жидкостей, реакций, сопровождающихся уменьшением числа молекул.
Пользуясь справочными данными , рассчитаем DS°298 реакции (а).
4Al (тв.) + 3PbO2 (тв.) = 2Al2O3 (тв.) + 3Pb (тв.)
S°298 4×28,32 3×76,6 2×50,99 3×64,89
DS°298 = 2×50,99+3×64,89–4×28,32–3×76,6 = –46,4 Дж/К.
Таким образом, энтропийный фактор препятствует протеканию этой реакции, а энергетический фактор (см. выше) – благоприятствует.
Идет ли реакция на самом деле? Чтобы ответить на этот вопрос, нужно одновременно рассмотреть оба фактора: энтальпийный и энтропийный.
§ 5. Свободная энергия Гиббса. Критерии самопроизвольности протекания химических реакций.Одновременный учет энергетического и энтропийного факторов приводит к понятию еще одной полной функции состояния – свободной энергии. Если измерения проводятся при постоянном давлении, то величина называется свободной энергией Гиббса (в старой химической литературе – изобарно-изотермическим потенциалом) и обозначается DG.
Свободная энергия Гиббса связана с энтальпией и энтропией соотношением:
DG = DH – TDS (7.10)
где T – температура в кельвинах. Изменение свободной энергии Гиббса в ходе реакции образования 1 моля вещества из простых веществ в стандартных состояниях называется свободной энергией образования ΔG° и обычно выражается в кДж/моль. Свободные энергии образования простых веществ приняты равными нулю. Чтобы найти изменение свободной энергии Гиббса в ходе реакции, нужно от суммы свободных энергий образования продуктов отнять сумму свободных энергий образования реагентов с учетом стехиометрических коэффициентов:
DG(реакции) = SDG(продуктов) – SDG(реагентов) (7.11)
Самопроизвольным реакциям соответствует DG < 0. Если DG > 0, то реакция при данных условиях невозможна. Рассмотрим реакцию (a)
4Al (тв.) + 3PbO2 (тв.) = 2Al2O3 (тв.) + 3Pb (тв.)
ΔG°298 0 3×(–219,0) 2×(–1576,5) 0
ΔG°298 = 2×(–1576,5)–3×(–219,0) = –2496 кДж.
Существует и другой способ расчета DG реакции. Выше мы нашли значения ΔH и ΔS, тогда DG = DH – TDS
DG°298 = –2509,8 кДж – 298,15 К×(–0,0464 кДж/К) = –2496 кДж.
Таким образом, реакция (1) при стандартных условиях протекает самопроизвольно. Знак ΔG показывает возможность осуществления реакции только в условиях, для которых проводились вычисления. Для более глубокого анализа необходимо раздельное рассмотрение энергетического и энтропийного факторов. Имеется четыре возможных случая:
Таблица 7.3.
Определение возможности протекания химической реакции
| Критерии | Возможность |
| DH < 0, DS > 0 | Оба фактора благоприятствуют реакции. Как правило, такие реакции протекают быстро и полностью. |
| DH < 0, DS < 0 | Энергетический фактор благоприятствует реакции, энтропийный препятствует. Реакция возможна при низких температурах. |
| DH > 0, DS > 0 | Энергетический фактор препятствует реакции, энтропийный благоприятствует. Реакция возможна при высоких температурах. |
| DH > 0, DS < 0 | Оба фактора препятствуют реакции. Такая реакция невозможна. |
Если при стандартных условиях DG реакции > 0, но энергетический и энтропийный факторы направлены противоположно, то можно рассчитать, при каких условиях реакция станет возможной. DH и DS химической реакции сами по себе слабо зависят от температуры, если какие-нибудь из реагентов или продуктов не испытывают фазовых переходов. Однако в энтропийный фактор помимо DS входит также и абсолютная температура T. Таким образом, с повышением температуры роль энтропийного фактора повышается, и при температуре выше T » DH/DS реакция начинает идти в обратном направлении.
Если DG = 0, то система находится в состоянии термодинамического равновесия, т.е. DG – термодинамический критерий химического равновесия реакций (смотри вышеприведенные фазовые переходы воды).
Итак, анализируя функции состояния системы – энтальпию, энтропию и свободную энергию Гиббса – и их изменение в ходе химической реакции, можно определить, будет ли данная реакция происходить самопроизвольно, и тем самым ответить на вопросы, поставленные в начале этой лекции.
Более полно термодинамика отражена в курсе физической химии, а с прикладными ее аспектами вы ознакомитесь в курсах теплотехники и др.
Лекция 9
Дата добавления: 2015-08-11; просмотров: 1700;
