Квантовые числа. Атомные орбитали.
Волновую функцию (7), описывающую состояние электрона, называют атомной орбиталью (АО).
Квантовые числа. В квантовой механике каждая АО определяется тремя квантовыми числами.
Главное квантовое число n. Может принимать целочисленные значения от 1 до ∞. Главное квантовое число определяет:
номер энергетического уровня;
интервал энергий электронов, находящихся на данном уровне;
размеры орбиталей;
число подуровней данного энергетического уровня (первый уровень состоит из одного подуровня, второй – из двух, третий – из трех и т.д.);
В Периодической системе элементов максимальному значению главного квантового числа соответствует номер периода.
Орбитальное квантовое число l.Определяет орбитальный момент количества движения (импульс) электрона, точное значение его энергии и форму орбиталей. Может принимать значения 0, 1, 2, 3, …, (n-1).
Атомная орбиталь – геометрический образ одноэлектронной волновой функции ψ, представляющий собой область наиболее вероятного пребывания электрона в атоме. Она ограничивает область пространства, в которой вероятность нахождения электрона имеет определенное значение (90 …99 %). Иногда орбиталью называют граничную поверхность этой области, а на рисунках, как правило, изображают сечение этой области плоскостью, проходящей через начало координат и лежащей в плоскости рисунка. В начало координат помещают центр ядра атома. Понятие «орбиталь», в отличие от «орбита», не подразумевает знания точных координат электрона. Орбитальное квантовое число определяет форму атомной орбитали. При l =0 это сфера, при l =1 – объемная восьмерка (гантель), при l=2 – четырехлепестковая розетка.
Каждому значению главного квантового числа соответствует n значений орбитального квантового числа l (табл. 1). Например, если n=1, то l принимает только одно значение (l =0), n =2 – два значения: 0 и 1 и т.д. Каждому численному значению l соответствует определенная геометрическая форма орбиталей и приписывается буквенное обозначение. Первые четыре буквы обозначения имеют историческое происхождение и связаны с характером спектральных линий. s, p, d, f – первые буквы английских слов, использованных для названия спектральных линий: sharp (резкий), principal (главный), diffuse (диффузный), fundamental (основной). Обозначения других орбиталей приведены в алфавитном порядке: g, h, …
Таблица 1
Значения главного и орбитального квантовых чисел
| Орбитальное квантовое число l | Главное квантовое число n | ||||||||||||||
| Значение Буквенное обозначение | s | s | p | s | p | d | s | p | d | f | s | p | d | f | g |
Обозначение любого подуровня определяется двумя квантовыми числами – главным (при записи указывается численное значение) и орбитальным (при записи указывается буквенное обозначениеорбитальным ()ается численное значение двумя квантовыми числами - главным ). Например, энергетический подуровень, для которого n =2 и l =1, следует обозначить так: 2р-подуровень. Все орбитали с одинаковым значением l имеют одинаковую геометрическую формулу и в зависимости от значений главного квантового числа различаются размерами. Например, все орбитали, для которых l =0 (s-орбитали) являются сферически симметричными, различаются размерами в зависимости от значения главного квантового числа. Чем выше значение n, тем больше размеры орбиталей.
Магнитное квантовое число ml.Определяет возможные значения проекции орбитального момента количества движения электрона на фиксированное направление в пространстве (например, на ось z). Оно принимает отрицательные и положительные значения l, включая нуль. Общее число значений равно 2l+1:
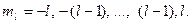
От значения магнитного квантового числа зависит взаимодействие магнитного поля, создаваемого электроном, с внешним магнитным полем. Если нет внешнего магнитного поля, то энергия электрона в атоме не зависит от ml. В этом случае электроны с одинаковыми значениями n и l, но с разными значениями ml обладают одинаковой энергией. Если существует внешнее магнитное поле – энергия электронов с разными ml различается.
В общем случае магнитное квантовое число характеризует ориентацию АО в пространстве относительно внешней силы. Магнитное квантовое число определяет ориентацию орбитального углового момента относительно некоторого фиксированного направления.
Общее число возможных значений ml соответствует числу способов расположения орбиталей данного подуровня в пространстве, то есть общему числу орбиталей на данном подуровне (табл. 2).
Таблица 2
Число орбиталей на подуровне
| Главное квантовое число n | Число значений ml | Квантовое число | |
| l | ml | ||
| 0 (s) 0 (s) 1 (p) 0 (s) 1 (p) 2 (d) | -1, 0, +1 -1, 0, +1 -2, -1, 0, +1, +2 |
Орбитальному квантовому числу l =0 отвечает единственное значение магнитного квантового числа ml =0. Эти значения l и ml характеризуют все s-орбитали, которые имеют форму сферы. Так как в этом случае магнитное квантовое число принимает только одно значение, то каждый s-подуровень состоит только из одной орбитали. Рассмотрим любой р-подуровень. При l =1 орбитали имеют форму гантелей (объемные восьмерки), магнитное квантовое число принимает следующие значения: ml = -1, 0, +1. Следовательно, р-подуровень состоит из трех АО, которые располагаются вдоль осей координат, их обозначают px, py, pz соответственно (рис. 1).
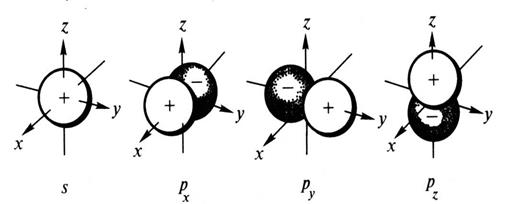
Рис. 1. Пространственная форма s- и р-атомных орбиталей.
Для d-подуровня l =2, ml = -2, -1, 0, +1, +2 (всего 5 значений), и любой d-подуровень состоит из пяти атомных орбиталей, которые определенным образом расположены в пространстве (рис. 2), и обозначаются 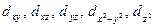 соответственно.
соответственно.
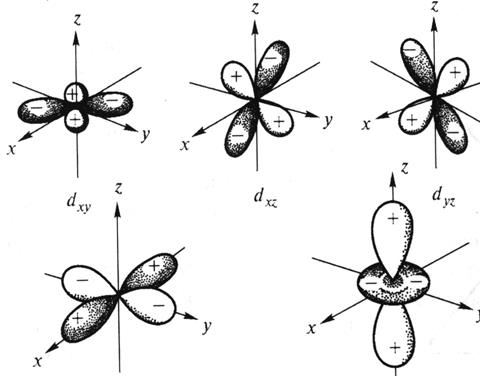
Рис. 2. Пространственная форма d-атомных орбиталей.
Четыре из пяти d-орбиталей имеют форму четырехлепестковых розеток, каждая из которых образована двумя гантелями, пятая АО представляет собой гантель с тором в экваториальной плоскости ( 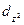 -орбиталь) и расположена вдоль оси z. Лепестки орбитали
-орбиталь) и расположена вдоль оси z. Лепестки орбитали 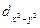 расположены вдоль осей x и y. Лепестки орбиталей
расположены вдоль осей x и y. Лепестки орбиталей 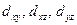 расположены симметрично между соответствующими осями.
расположены симметрично между соответствующими осями.
Четвертый энергетический уровень состоит из четырех подуровней – s, p, d и f. Первые три из них аналогичны описанным выше, а четвертый f-подуровень состоит из семи АО, пространственная форма которых достаточно сложна и в данном разделе не рассматривается.
С. Гаудсмит и Дж. Уленбек для описания некоторых тонких эффектов в спектре атома водорода в 1925 г. выдвинули гипотезу о наличии собственного момента импульса электрона, который назвали спином. Спин нельзя выразить через координаты и импульсы, у него нет аналога в классической механике. Спиновое число s электрона принимает только одно значение, равное 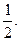 Проекция вектора спина на определенное направление внешнего поля (например, на ось z) определяется спиновым квантовым числом mS, которое может принимать два значения: mS =
Проекция вектора спина на определенное направление внешнего поля (например, на ось z) определяется спиновым квантовым числом mS, которое может принимать два значения: mS = 
Понятие «спин» введено для характеристики специфического квантового свойства электрона. Спин – это проявление релятивистских эффектов на микроскопическом уровне.
Электрон имеет четыре степени свободы. Спиновое квантовое число принимает только дискретные значения: 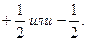 Таким образом, состояние электрона в атоме определяется набором значений четырех квантовых чисел: n, l, ml, mS.
Таким образом, состояние электрона в атоме определяется набором значений четырех квантовых чисел: n, l, ml, mS.
Обозначение и структура электронных энергетических уровней. Определим некоторые термины, которые используются для разъяснения физического смысла квантовых чисел. Группа орбиталей, имеющих одинаковое значение орбитального квантового числа, образует энергетический подуровень. Совокупность всех орбиталей с одинаковым значением главного квантового числа образует энергетический уровень.
Структуру атомных электронных уровней можно изобразить двояко: в виде электронных формул и электронографических диаграмм. При написании электронных формул используют два квантовых числа n и l: первый уровень – 1s; второй – 2s, 2p; третий – 3s, 3p, 3d; четвертый – 4s, 4p, 4d, 4f и т.д. (табл.3).
Таблица 3
Структура электронных энергетических уровней атома
| Главное квантовое число n | Обозначение подуровня | Квантовое число | |
| l | ml | ||
| 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f | -1, 0, +1 -1, 0, +1 -2, -1, 0, +1, +2 -1, 0, +1 -2, -1, 0, +1, +2 -3, -2, -1, 0, +1, +2, +3 |
Более полно строение электронных уровней описывается с использованием трех квантовых чисел: n, l, ml . Каждая АО условно изображается в виде квантовых ячеек, около которой ставится номер уровня и символ подуровня.
Дата добавления: 2015-08-08; просмотров: 3155;
