Строение атома. Квантово-механическая модель атома.
До конца 19 века атом считался неделимым. Затем по мере накопления опытных данных пришлось отказаться от таких взглядов и признать, что атомы имеют сложное строение.
Для объяснения опытных данных по рассеянию 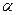 - частиц Э. Резерфорд предложил ядерную модель атома. Согласно этой модели атом состоит из массивного положительно заряженного ядра, при этом очень малого по размерам. В ядре сосредоточена почти вся масса атома. Вокруг ядра на значительном расстоянии от него вращаются электроны, образующие электронную оболочку атома.
- частиц Э. Резерфорд предложил ядерную модель атома. Согласно этой модели атом состоит из массивного положительно заряженного ядра, при этом очень малого по размерам. В ядре сосредоточена почти вся масса атома. Вокруг ядра на значительном расстоянии от него вращаются электроны, образующие электронную оболочку атома.
Размер всего атома составляет около 10-8 см, ядра – порядка 10-13 см. По размеру ядро примерно в 100000 раз меньше атома.
Поскольку атом в целом электронейтрален, то суммарный заряд электронов должен быть равен заряду ядра. Дальнейшие исследования показали, что положительный заряд ядра атома численно равен порядковому номеру элемента в периодической системе Д.И. Менделеева.
Таким образом, число положительных зарядов ядра каждого атома, а также число вращающихся в поле ядра электронов равны порядковому номеру элемента.
Порядковый номер атома титана равен 22. Значит, его положительный заряд равен 22 и в поле ядра вращаются 22 электрона.
При химических реакциях ядро атома не претерпевает изменений. Изменению подвергаются электронные оболочки атомов, строением которых объясняются многие свойства химических элементов. Поэтому состояние электронов в атоме определяет многие свойства.
Электрон – это очень маленькая частица, для которой законы классической механики не выполняются. Такая частица не имеет траектории, обладает волновыми свойствами. Для её характеристики требуется привлечение других понятий. Состояние электронов в атоме описывается квантовой механикой.
Квантовая механика базируется на трех основных положениях:
энергетические изменения, происходящие в микросистемах, носят дискретный характер (принцип квантования энергии);
поведение микрочастиц (в том числе и электронов) определяется двойственностью их природы (корпускулярно-волновой дуализм);
законы микромира обусловлены статистическим (вероятностным) характером.
Квантование энергии. Для объяснения способностей излучения нагретых тел М. Планк в 1900 г. выдвинул предположение, что энергия излучается и поглощается не непрерывно, а дискретно отдельными порциями – квантами. Энергия Е кванта зависит от частоты электромагнитного излучения ν:
Е=hν (1),
где h – постоянная Планка; ν=с/λ (λ – длина волны излучения); с – скорость света. Идея о квантовании энергии позволила объяснить фотоэлектрический эффект (А.Эйнштейн,1905) и линейчатую структуру атомных спектров (Н. Бор,1913).
Корпускулярно-волновой дуализм характеризует способность любого объекта проявлять одновременно волновые и материальные свойства. Двойственная природа микромира была впервые установлена для излучения. С одной стороны, для излучения характерны такие явления, как интерференция и дифракция, которые характеризуют его волновую природу. С другой стороны, излучение проявляет свойства частиц, о чем свидетельствует явление фотоэффекта. Эйнштейн предположил, что излучение испускается в виде частиц, называемых фотонами или квантами. Каждый фотон обладает энергией, определяемой (1).
В силу корпускулярной природы излучения фотоны должны обладать определенной массой. Масса покоя фотона равна нулю, а при движении фотон приобретает динамическую массу. Для вычисления этой массы Эйнштейн обосновал применение уравнение эквивалентности массы и энергии:
Е=mc2.
В то же время Е=hν=h(с/λ). Отсюда следует
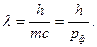 (2).
(2).
Здесь рф=mc – импульс фотона. Французский физик Л. де Бройль в 1923 г. предположил, что двойственной природой обладает не только свет, но и любой материальный объект (в частности, электрон). Длина волны любого движущегося объекта
 (3),
(3),
где m – масса частицы; 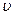 - скорость движения частицы; λ – длина волны объекта, называемая длиной волны де Бройля. Из этого выражения следует, что чем меньше масса частицы, тем больше длина ее волны и тем значительней проявляются ее волновые свойства.
- скорость движения частицы; λ – длина волны объекта, называемая длиной волны де Бройля. Из этого выражения следует, что чем меньше масса частицы, тем больше длина ее волны и тем значительней проявляются ее волновые свойства.
Уравнение де Бройля (3) в 1927 г. было подтверждено экспериментально. Американские физики Дж. Дэвиссон и А. Джермер обнаружили дифракцию электронов на монокристаллах никеля Ni. Позднее способность к дифракции была обнаружена у других микрообъемов (атомов гелия Не, молекул водорода Н2, нейтронов).
В макромире волновые свойства не проявляются – перемещение тел хорошо описывается как движение частиц. Причина заключается в том, что постоянная Планка очень мала, поэтому длины волн оказываются соизмеримыми с размерами частиц только в микромире.
Принцип неопределенности. Волновые свойства микрочастиц выражаются также в ограниченности применения к ним некоторых понятий классической механики, а именно координаты и импульса. Например, один из способов наблюдения за объектом – воздействие на него электромагнитного излучения (свет, радиоволны) и регистрация отраженного сигнала, что широко используется в радиолокации, эхолокации. Причем чем сильнее воздействие на наблюдаемый объект, тем сильнее отраженный сигнал. Если ведется наблюдение за микрообъектами, то действие на них электромагнитного излучения не изменяет ни их положения, ни их скорости. В случае наблюдения за объектами микромира (например, электронами) ситуация выглядит иначе. При действии кванта света (фотона) на микрочастицу ее скорость не остается без изменения. Зная положение микрочастицы в какой-то момент времени, нельзя в это же мгновение определить ее скорость, поскольку она уже изменилась.
В. Гейзенберг в 1927 г. предложил соотношения, которые получили название принципа неопределенности. Согласно этому принципу, невозможно одновременно точно определить координаты частица и ее импульс.
Математически принцип неопределенности формулируется следующим образом:
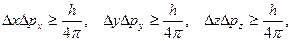
где Δx, Δy, Δz – погрешность определения координат x, y, z соответственно; Δpx, Δpy, Δpz – погрешность определения проекций импульса на оси координат. Из этих соотношений следует, что чем точнее определены координаты электрона, тем с меньшей точностью будет найден его импульс, и наоборот. Другими словами, говорить о траектории движения электрона не имеет смысла, так как для ее описания необходимо точно знать координаты электрона и его импульс в каждый момент времени. Из соотношений неопределенности следует, что точно описать движение такой микрочастицы, как электрон невозможно. Движение электрона можно описать, используя вероятностный подход, причем есть лишь определенная вероятность нахождения электрона в заданной области пространства.
Движущейся частице можно поставить в соответствие волновой процесс с длиной волны (3), тогда этот процесс будет характеризоваться частотой ν и волновой функцией Ψ – величиной, определяющей волнообразно распространяющееся возмущение.
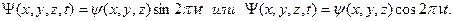
Здесь ψ(x, y, z) – амплитуда волн де Бройля или координатная волновая функция, зависящая только от пространственных координат.
Стационарное уравнение Шрёдингера.
Законы движения частиц в квантовой механике выражаютсяуравнением Шрёдингера, которое играет ту же роль, что и законы Ньютона в классической механике. Уравнение Шрёдингера представляет собой дифференциальное уравнение в частных производных. Э. Шрёдингер в 1926 г. предложил использовать волновое уравнение в качестве модели для описания поведения электрона в атоме – уравнение, связывающее энергию системы с ее волновым движением. Стационарное уравнение Шрёдингера для одной части можно записать в следующей форме:
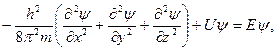 (4)
(4)
где U – потенциальная энергия частицы; Е – ее полная энергия; x, y, z – декартовы координаты. Входящую в (4) переменную величину называют ψ волновой функцией. Эта функция описывает все свойства системы в стационарном состоянии – состоянии, которое не изменяется во времени. Функция ψ зависит от координат частиц и может зависеть от времени. Квадрат ее абсолютной величины |ψ|2 характеризует вероятность нахождения частицы в данном месте пространства. Величина |ψ|2dV равна вероятности нахождения рассматриваемой частицы в элементе объема dV=dxdydz.
Уравнение Шрёдингера часто записывают в следующей форме:

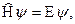 (5)
(5)
где 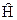 - оператор Гамильтона:
- оператор Гамильтона:
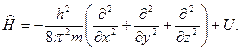 (6)
(6)
Квантово-механическое решение задач в теории атома и молекулы сводится к нахождению удовлетворяющих уравнению Шрёдингера волновых функций и значений энергии. Вообще говоря, может быть несколько различных функций ψ1, ψ2, ψ3, …, ψn, которые являются решениями уравнения Шрёдингера, причем каждой соответствует свое значение энергии E1, E2, …, En.
Волновые функции, для которых уравнение Шрёдингера имеет решение, называют собственными функциями; значения энергии, вычисленные из таких решений – собственными значениями.
Таким образом, согласно представлениям квантовой механики, вероятность пребывания электрона в различных областях пространства неодинакова. Современным представлениям отвечает понятие об электронном облаке, плотность которого в различных точках определяется |ψ|2. В научной литературе используют понятие «орбиталь», которое характеризует совокупность положений электрона в атоме. Каждой орбитали соответствует определенная волновая функция.
Уравнение (6) в сферических координатах приобретает вид
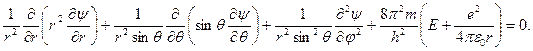
Решая это уравнение, получают
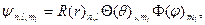 (7)
(7)
где R(r) – радикальная составляющая волновой функции; Θ(θ) и Φ(φ) – угловые составляющие волновой функции. Следовательно, волновые функции в (7) зависят от трех целочисленных параметров n, l и m, которые называют квантовыми числами.
Дата добавления: 2015-08-08; просмотров: 1216;
