Полярность молекул (типы ковалентных молекул)
Следует отличать полярность молекулы от полярности связи. Для двухатомных молекул типа АВ эти понятия совпадают, как это уже показано на примере молекулы HCl. В таких молекулах чем больше разность электроотрицательностей элементов (∆ЭО), тем больше электрический момент диполя. Например, в ряду HF, HCl, HBr, HI он уменьшается в той же последовательности, как и относительная электроотрицательность.
Молекулы могут быть полярными и неполярными в зависимости от характера распределения электронной плотности молекулы. Полярность молекул характеризуется значением электрического момента диполя μм, который равен векторной сумме электрических моментов диполей всех связей и несвязывающих электронных пар в молекулах. Результат сложения зависит от полярности связей, геометрического строения молекулы, наличия неподеленных электронных пар. Большое влияние на полярность молекулы оказывает её симметрия.
Например, молекула СО2 имеет симметричное линейное строение:


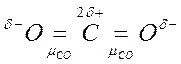 .
.
Поэтому, хотя связи С=О и имеют сильно полярный характер, вследствие взаимной компенсации их электрических моментов диполя молекула СО2 в целом неполярна ( 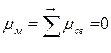 ). По этой же причине неполярны высокосимметричные тетраэдрические молекулы СН4, СF4, октаэдрическая молекула SF6 и т. д.
). По этой же причине неполярны высокосимметричные тетраэдрические молекулы СН4, СF4, октаэдрическая молекула SF6 и т. д.
Напротив, в угловой молекуле Н2О полярные связи О–Н располагаются под углом 104,5º. Поэтому их моменты взаимно не компенсируются и молекула оказывается полярной ( 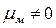 ).
).
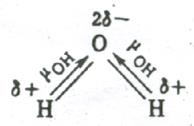
Электрическим моментом диполя обладают также угловая молекула SO2, пирамидальные молекулы NH3, NF3 и т. д. Отсутствие такого момента
свидетельствует о высокосимметричной структуре молекулы, наличие электрического момента диполя – о несимметричности структуры молекулы (табл. 3.2).
Таблица 3.2
Строение и ожидаемая полярность молекул
| Тип | Пространственная конфигурация | Ожидаемая полярность | Примеры |

| Линейная | Неполярная |  , , 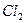 , , 
|
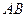
| Линейная | Полярная | 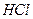 , , 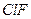
|
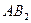
| Линейная | Неполярная | 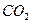 , , 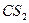 , , 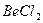
|
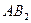
| Угловая | Полярная | 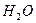 , , 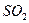 , , 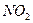
|
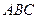
| Линейная | Полярная | 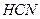
|
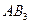
| Плоскотреугольная | Неполярная |  , , 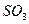
|
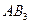
| Тригонально-пирамидальная | Полярная | 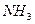 , , 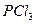 , , 
|

| Тетраэдрическая | Неполярная | 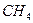 , , 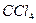 , , 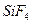
|
На значение электрического момента диполя молекулы сильно влияют несвязывающие электронные пары. Например, молекулы NH3 и NF3 имеют одинаковую тригонально-пирамидальную форму, полярность связей N–H и N–F также примерно одинакова. Однако электрический момент диполя NH3 равен 0,49·10-29 Кл·м, а NF3 всего 0,07·10-29 Кл·м. Это объясняется тем, что в NH3 направление электрического момента диполя связывающей N–H и несвязывающей электронной пары совпадает и при векторном сложении обусловливает большой электрический момент диполя. Наоборот, в NF3 моменты связей N–F и электронной пары направлены в противоположные стороны, поэтому при сложении они частично компенсируются (рис. 3.15).


Рис 3.15. Сложение электрических моментов диполя связывающих и несвязывающих электронных пар молекул NH3 и NF3
Неполярную молекулу можно сделать полярной. Для этого её надо поместить в электрическое поле с определенной разностью потенциалов. Под действием электрического поля «центры тяжести» положительных и отрицательных зарядов смещаются и возникает индуцированный или наведенный электрический момент диполя. При снятии поля молекула опять станет неполярной.
Под действием внешнего электрического поля полярная молекула поляризуется, т. е. в ней происходит перераспределение зарядов, и молекула приобретает новое значение электрического момента диполя, становится ещё более полярной. Это может происходить и под влиянием поля, создаваемого приблизившейся полярной молекулой. Способность молекул поляризоваться под действием внешнего электрического поля называют поляризуемостью.
Полярностью и поляризуемостью молекул обусловлено межмолекулярное взаимодействие. С электрическим моментом диполя молекулы связана реакционная способность вещества, его растворимость. Полярные молекулы жидкостей благоприятствуют электролитической диссоциации растворенных в них электролитов.
Дата добавления: 2015-08-08; просмотров: 1145;
