Ионная связь. При взаимодействии двух атомов, обладающих весьма различными электроотрицательностями, общая пара электронов может быть практически полностью смещена к атому
При взаимодействии двух атомов, обладающих весьма различными электроотрицательностями, общая пара электронов может быть практически полностью смещена к атому с большей электроотрицательностью. В результате образуются две заряженные частицы – два иона, между которыми действуют силы электростатического притяжения.
Связь, которая осуществляется в результате образования и электростатического взаимодействия противоположно заряженных ионов, называется ионной.
Например, ионная связь возникает между цезием и фтором, разница ЭО у которых составляет более трёх единиц. К типичным соединениям с ионной связью относятся галогениды щелочных металлов, например CsF, CsCl, NaCl.
Ионная связь характеризуется:
- ненаправленностью, так как электрическое поле иона имеет сферический характер и равноценно во всех направлениях;
- ненасыщаемостью, поскольку при взаимодействии ионов не происходит полной взаимной компенсации их силовых полей (рис. 3.16) и ионы сохраняют способность электростатически взаимодействовать с другими ионами.
Из-за отсутствия у ионной связи направленности и насыщаемости каждый ион окружен ионами противоположного знака, число которых определяется размерами и силой отталкивания одноименно заряженных ионов. Поэтому соединения с ионной связью представляют собой кристаллические вещества. Весь кристалл можно рассматривать как единую гигантскую молекулу, состоящую из очень большого числа ионов. Лишь при высоких температурах, когда вещество переходит в газообразное состояние, ионные соединения могут существовать в виде неассоциированных молекул.
 Теория ионной связи разработана в 1916 г. немецким ученым В. Косселем. Согласно этой теории, устойчивой конфигурацией является оболочка инертного газа s2p6. Все атомы, участвующие в химическом взаимодействии, стремятся приобрести устойчивую оболочку инертного газа. При этом атомы металлов отдают свои валентные электроны, приобретая оболочку предыдущего инертного газа и положительный заряд. Атомы неметаллов принимают электроны, приобретая оболочку последующего инертного газа и отрицательный заряд. Например:
Теория ионной связи разработана в 1916 г. немецким ученым В. Косселем. Согласно этой теории, устойчивой конфигурацией является оболочка инертного газа s2p6. Все атомы, участвующие в химическом взаимодействии, стремятся приобрести устойчивую оболочку инертного газа. При этом атомы металлов отдают свои валентные электроны, приобретая оболочку предыдущего инертного газа и положительный заряд. Атомы неметаллов принимают электроны, приобретая оболочку последующего инертного газа и отрицательный заряд. Например:

 К 3s23p64s1 – 1eˉ K+ 3s23p6 ;
К 3s23p64s1 – 1eˉ K+ 3s23p6 ;
F 2s22p5 + 1eˉ F 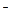 2s22p6.
2s22p6.
Полного перехода электрона от одного атома к другому в действительности не происходит даже в типичных ионных соединениях – галогенидах щелочных металлов. Например, в кристалле NaCl эффективный отрицательный заряд атома хлора составляет лишь 0,94 заряда электрона; таким же по абсолютной величине положительным зарядом обладает и атом натрия. Нельзя провести точную границу между ионной связью и ковалентной полярной связью, можно оценивать только степень ионности связи, которая количественно характеризуется эффективными зарядами атомов (d) в молекуле. Можно сказать, что ионная связь является предельным случаем ковалентной полярной связи, для которой эффективный заряд атомов по абсолютной величине близок к единице. Принято считать связь ионной, если разность электроотрицательностей атомов (DЭО) больше 1,9 или ½d½>0,5. Таким образом, природа химической связи едина и существующее различие между видами связей имеет количественный характер.
Свойства ионов:
1.Ионы обладают поляризующим действием – способностью деформировать, смещать электронную оболочку соседнего иона. В большей степени этим свойством обладают катионы. Поляризующее действие зависит, во-первых, от заряда и радиуса иона: чем больше заряд и меньше радиус иона, тем сильнее его поляризующее действие. Например:
а) Pb0 Pb2+ Pb4+
r, Å 1,74 1,32 0,84
-------------------------------------->
поляризующее действие усиливается;
б) Li+ Na+ K+ Rb+ Cs+
---------------------------------------------------------->
радиус ионов увеличивается, поляризующее действие уменьшается.
Во-вторых, чем больше электронов имеет катион металла на внешнем энергетическом уровне, тем больше его поляризующее действие. Например, в ряду: Ca2+ (8eˉ)1, Fe2+ (14eˉ), Zn2+ (18eˉ) поляризующее действие ионов усиливается.
2. Поляризуемость – это способность иона деформироваться под действием электрического поля соседнего иона. У ионов с одинаковым зарядом и одинаковым строением внешней электронной оболочки поляризуемость возрастает с увеличением размеров ионов. Например:
а) Li+ Na+ K+ Rb+ Cs+
---------------------------------------------------------->
радиус ионов увеличивается, поляризуемость возрастает;
б) F- Cl- Br- I-
---------------------------------------------------------->
радиус ионов увеличивается, поляризуемость возрастает.
Легче поляризуются отрицательно заряженные ионы (анионы). Их размеры по сравнению с атомами возрастают, отталкивание между электронами увеличивается и поляризуемость возрастает. В первом приближении можно считать, что деформации подвергается только внешняя электронная оболочка иона.
Дата добавления: 2015-08-08; просмотров: 761;
