Полярность и поляризуемость химической связи
Ковалентная связь, в которой обобществленная электронная плотность (обобществленные электроны, связующее электронное облако) симметрична по отношению к ядрам взаимодействующих атомов, называется неполярной ковалентной связью. Такая связь реализуется в молекулах простых веществ, состоящих из одинаковых атомов (Н-Н, О=О, Cl-Cl, N≡N и т. д.). Она может появляться между разными атомами, обладающими одинаковой относительной электроотрицательностью. Например, в молекуле РН3 связи Р-Н неполярные ковалентные, т. к. ЭО(Н)=2,1 и ЭО(Р)=2,1.
Ковалентная связь с несимметричным распределением обобществленной электронной плотности называется полярной ковалентной связью.
Если связь образована атомами разной природы и один из атомов сильнее притягивает электроны, то обобществлённая электронная пара смещается в сторону этого атома. В этом случае возникает полярная ковалентная связь. Критерием способности атома притягивать электрон служит электроотрицательность. Чем выше ЭО у атома, тем больше смещение электронной пары в сторону ядра данного атома. Поэтому разность электроотрицательностей атомов (ΔЭО) характеризует полярность связи.
 Например, образование молекулы хлорида водорода НСl можно представить схемой:
Например, образование молекулы хлорида водорода НСl можно представить схемой:
 Обобществленная электронная пара смещена к атому хлора, так как электроотрицательность хлора (ЭО=3) больше, чем атома водорода (ЭО=2,1). Смещение связующего электронного облака называют поляризацией. Вследствие этого заряд ядра водорода не компенсируется, а в атоме хлора электронная плотность становится избыточной по сравнению с зарядом ядра. Иными словами, атом водорода в HCl поляризован положительно, а атом хлора - отрицательно. На атоме водорода возникает положительный заряд, на атоме хлора – отрицательный. Заряды атомов в молекуле, возникающие из-за различия в электроотрицательностях, называют эффективными (δ). Эффективный заряд δ можно установить экспериментально, в молекуле HCl δCl= -0,18, δн= +0,18 абсолютного заряда электрона. Вследствие этого возникает диполь, представляющий собой электрически нейтральную систему с двумя одинаковыми по величине положительными и отрицательным зарядами, находящимися на определенном расстоянии (длина диполя) ℓ друг от друга. Мерой полярности связи служит электрический момент диполя
Обобществленная электронная пара смещена к атому хлора, так как электроотрицательность хлора (ЭО=3) больше, чем атома водорода (ЭО=2,1). Смещение связующего электронного облака называют поляризацией. Вследствие этого заряд ядра водорода не компенсируется, а в атоме хлора электронная плотность становится избыточной по сравнению с зарядом ядра. Иными словами, атом водорода в HCl поляризован положительно, а атом хлора - отрицательно. На атоме водорода возникает положительный заряд, на атоме хлора – отрицательный. Заряды атомов в молекуле, возникающие из-за различия в электроотрицательностях, называют эффективными (δ). Эффективный заряд δ можно установить экспериментально, в молекуле HCl δCl= -0,18, δн= +0,18 абсолютного заряда электрона. Вследствие этого возникает диполь, представляющий собой электрически нейтральную систему с двумя одинаковыми по величине положительными и отрицательным зарядами, находящимися на определенном расстоянии (длина диполя) ℓ друг от друга. Мерой полярности связи служит электрический момент диполя 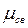 , равный произведению эффективного заряда δ на длину диполя ℓ:
, равный произведению эффективного заряда δ на длину диполя ℓ:
Электрический момент диполя имеет единицу измерения кулон на метр (Кл∙м). В качестве единицы измерения используют также внесистемную единицу измерения дебай D, равную 3,3∙10-30 Кл∙м. Как видно из данных, представленных в табл. 3.1, электрический момент диполя растёт с увеличением разности ЭО.
Таблица 3.1
Электрический момент диполя химической связи в молекулах
| Связь | Разность ЭО | μсв, D | Связь | Разность ЭО | μсв, D |
| H-F | 1,9 | 1,98 | H-O | 1,4 | 1,53 |
| H-Cl | 0,9 | 1,03 | H-N | 0,9 | 1,3 |
| H-Br | 0,74 | 0,78 | H-S | 0,4 | 0,7 |
| H-I | 0,4 | 0,38 | H-C | 0,4 | 0,3 |
Электрический момент момент диполя – векторная величина. Направление его условно принимают от положительного заряда к отрицательному – в сторону смещения связующего электронного облака (или от атома элемента с меньшей ЭО к атому элемента с большей ЭО). Для рассмотренной молекулы HCl:
Поляризуемость связи. Для характеристики реакционной способности молекул важно знать не только исходное распределение электронной плотности, но и ее поляризуемость. Последняя характеризует способность становиться полярной (или более полярной) в результате действия на молекулу внешнего электрического поля. Так как с каждым атомом или молекулой, в свою очередь, связано электрическое поле, то соединение должно поляризоваться также и при действии на молекулу других молекул, скажем, партнера по реакции.
В результате поляризации может произойти полный разрыв связи с переходом связывающей электронной пары к одному из атомов и образованием отрицательного и положительного ионов. Асимметричный разрыв связи с образованием разноименных ионов называется гетеролитическим:
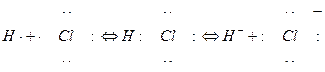
гомолитический разрыв гетеролитический разрыв
(диссоциация) (ионизация)
Гетеролитический разрыв отличается от разрушения связи при распаде молекулы на атом и радикал. В последнем случае разрушается связывающая электронная пара, и процесс называется гомолитическим. В соответствии со сказанным следует различать процесс диссоцаации и процесс ионизации; в случае HCl первый наблюдается при термическом распаде на атомы, второй – при распаде на ионы в растворе.
Степень окисления элементов. Пользуясь представлением об электроотрицательности элементов, можно дать количественную оценку состояния атома в соединении в виде так называемой степени окисления.
Степень окисления (с.о.) – это условный заряд, который приписывается атому в предположении, что все связи в молекуле или ионе предельно поляризованы.
Степень окисления элемента в составе молекулы вещества или иона определяется как число электронов, смещенных от атома данного элемента (положительная степень окисления) или к атому данного элемента (отрицательная степень окисления).
Для вычисления степени окисления элемента в соединении следует исходить из положений (правил), изложенных в разделе 9.
Понятие степени окисления имеет условный характер, т. к. не отражает реальный эффективный заряд атома. Так, в HCl с.о.(Н)=+1, с.о.(Cl)=-1, а δН=+0,18, δCl=-0,18.
Дата добавления: 2015-08-08; просмотров: 1048;
