Электролиз водных растворов электролитов.
Молекулы воды могут окисляться и восстанавливаться, следовательно, на катоде и аноде конкурируют реакции восстановления и окисления катионов и анионов и молекул воды.
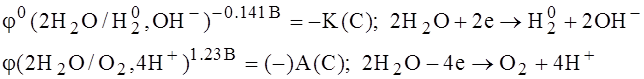 Электролиз водных растворов KJ.
Электролиз водных растворов KJ.
На катоде К(С): K++1е 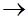 К0
К0 
2J- -2e 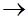 J20
J20 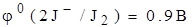
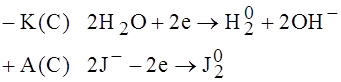
При электролизе водных растворов металла, характерная величена стандартного электродного потенциала меньше, чем 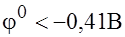 , из водных растворов катионы таких металлов не восстанавливаются. Эти металлы можно получить только при электролизе металлов их солей (металлы щелочные, щелочноземельные, алюминий).
, из водных растворов катионы таких металлов не восстанавливаются. Эти металлы можно получить только при электролизе металлов их солей (металлы щелочные, щелочноземельные, алюминий).
Электролиз с растворенным анодом. В случае использования в качестве анода металла анодов наряду с процессами окисления анионов молекул может происходить окисление анода. Если в металле анод окисляется, он переходит в виде катиона в электролит, следовательно, имеет место растворение анода. Кроме того, некоторые металлы можно подвергать окислению с участием кислорода и тогда окисление электрода приводит к покрытию металла пленкой окисла. Такие процессы называют анодным оксидированием, и они используются для нанесения антикоррозионных и уплотняющих покрытий на поверхность металла. Чаще всего анодно оксидируют алюминий конструкции.
Дата добавления: 2015-08-08; просмотров: 660;
