Законы Фарадея.
Масса вещества, выделившегося на электроде, прямо пропорциональна количеству электричества прошедшего через раствор.
m(B)=kIt
It=Q
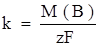
где I – постоянный ток;
t – время пропускания тока;
k – электрохимический эквивалент;
М – молярная масса вещества;
F – постоянная Фарадея;
z – число электронов участвующих в процессе.
Следствие: при прохождении одинакового количества электронов через систему последовательно соединенных электролизеров масса веществ, превращающихся на электродах пропорциональны их эквивалентным массам (соблюдается закон эквивалентов).
В реальных условиях на электролизере, возможно, протекает одновременно несколько реакций, в этих случаях на получение данного продукта затрачивается доля общего количества электричества, которое выражают в процентах и называют выход по току.
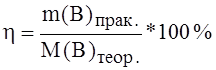
Применение электролиза:
1. нанесение покрытий на поверхности твердых тел (металлом или оксидами металла);
2. получение щелочных, щелочноземельных металлов и алюминия;
3. получение самых активных окислителей.
Дата добавления: 2015-08-08; просмотров: 643;
