Ряд напряжений металлов.
Ряд напряжений металлов – это ряд металлов расположенных по возрастанию их стандартного электродного потенциала ( 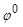 ). Положение металла в ряду напряжений свидетельствует о его окислительно-восстановительных способностях по отношению к другим металлам и их катионам для реакций, протекающих в растворах электролитах, т. е. в реакциях с солями и основаниями. А также с неметаллами, если эти реакции протекают в водных растворах в частности к таким процессам относятся процессы коррозии металлов (
). Положение металла в ряду напряжений свидетельствует о его окислительно-восстановительных способностях по отношению к другим металлам и их катионам для реакций, протекающих в растворах электролитах, т. е. в реакциях с солями и основаниями. А также с неметаллами, если эти реакции протекают в водных растворах в частности к таким процессам относятся процессы коррозии металлов ( 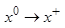 ).
).
В ряду напряжений:
1) Уменьшается восстановительная способность металлов.
2) Увеличивается окислительная способность. Как следствие этого металлы, стоящие в ряду напряжений до водорода [ 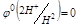 ] вытесняют его из растворов кислот (не окислителей).
] вытесняют его из растворов кислот (не окислителей).
3) Металлы, стоящие в ряду левее (имеющие меньший потенциал) вытесняют металлы стоящие правее (имеющие больший потенциал) из растворов их солей.
4) Металлы, стоящие в ряду напряжений до Mg (имеющие 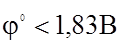 ) вытесняют водород из воды.
) вытесняют водород из воды.
Таким образом значение электродного потенциала определяет окислительно-восстановительные способности металлов по отношению друг к другу и по отношению к H и содержащие его катионы электролитам.
Измерение электродных потенциалов. Ряд стандартных электродных потенциалов, водородный электрод.
Абсолютное значение электродного потенциала измерить практически невозможно. В связи с этим электродный потенциал измеряется путем измерения ЭДС гальванического элемента составленного из исследуемого электрода и электрода потенциал, которого известен. Стандартный электродный потенциал определяется величиной ЭДС гальванического элемента, составленного из исследуемого электрода и стандартного водородного электрода, потенциал которого условно принимается равным нулю.
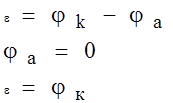
Стандартный водородный электрод – Это система, находящаяся при нормальных условиях, состоящая из губчатой пластины, в поры которой нагнетают водород [ 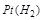 ], помещённую в одномоляльный раствор серной кислоты
], помещённую в одномоляльный раствор серной кислоты 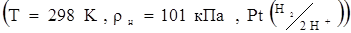 H2SO4 с C(H+)=1моль/кг
H2SO4 с C(H+)=1моль/кг
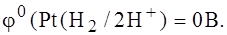
Стандартизировать условия и воспроизводить потенциал такого электрода является сложной задачей, поэтому данный электрод используется в метеорологических целях. В лабораторной практике для измерения электродных потенциалов используют вспомогательные электроды.
Пример: каломельный электрод - Hg,HgCl/Cl-;
хлор серебряный – Ag, AgCl/Cl- и т.д.
Потенциал этих электродов устойчиво воспроизводится, то есть сохраняет свое значение при хранении и эксплуатации.
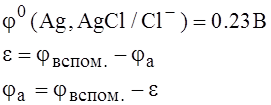
Учитывая, что электродные потенциалы зависят от температуры и от концентрации электролита можно стабилизировав температуру измеряя потенциалы рассчитать концентрации электролита, то есть содержание С(Ме+) в среде, в которой этот Ме находится (в том числе и С(H+).
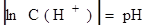
Дата добавления: 2015-08-08; просмотров: 2247;
