ХИМИЧЕСКИЕ КОМПОНЕНТЫ ЖИВОГО
Химия биологически активных веществ (биоорганическая химия) по своему содержанию с одной стороны является частью органической химии, так как изучает углерод и его соединения, а с другой стороны частью биологической химии, так как исследует только те соединения углерода, которые входят в состав живой материи.
Биоорганическая химия или, как ее раньше называли, статическая биохимия изучает качественный и количественный состав организмов – структуру биологических макромолекул и низкомолекулярных регуляторов. Она является первой ступенью в овладении биологической химией – наукой о химическом строении и функциях веществ, входящих в состав живой материи, и их превращениях в процессах жизнедеятельности. Биохимию можно считать основным языком всех биологических наук. Биохимия дает понимание того, как работают биологические системы. Это в свою очередь находит применение в сельском хозяйстве, в медицине, включая всю фармацевтическую промышленность, в различных бродильных производствах, которые поставляют нам широкий ассортимент пищевых и технических продуктов, в технологии производства и хранения пищевых продуктов, в ферментной технологии и производствах некоторых новых видов горючего.
Биоорганическая химия в биологии играет важную объединяющую роль. При рассмотрении на этом уровне бросаются в глаза не столько различия между живыми организмами, сколько их сходство. Все живые организмы состоят из одних и тех же молекул, используемых как строительные блоки, что указывает на их происхождение от общего предка. Структура биологических макромолекул проста в своей основе. Все биомолекулы выполняют в клетках специфические функции.
В живых организмах наиболее часто встречаются четыре элемента: водород, углерод, кислород и азот. На их долю приходится более 99% всех атомов, входящих в состав всех живых организмов, хотя в земной коре первые четыре места по распространенности занимают кислород, кремний, алюминий и натрий. Биологическое значение водорода, кислорода, азота и углерода связано в основном с их валентностью, равной соответственно 1, 2, 3 и 4, а также с их способностью образовывать более прочные ковалентные связи, чем связи, образуемые другими элементами той же валентности.
Углерод имеет ряд химических свойств, фундаментальных для жизни:
1) его атомы сравнительно малы и атомная масса невелика;
2) он способен образовывать четыре прочные ковалентные связи;
3) он образует С-С-связи, строя таким путем длинные углеродные скелеты молекул в виде цепей и колец;
4) он образует кратные ковалентные связи с другими углеродными атомами, а также с кислородом и азотом.
Больше всего в организмах содержится воды – от 60 до 95% общей массы. Уникальность воды для живого связана с ее довольно необычными физическими и химическими свойствами: малыми размерами молекул, полярностью ее молекул и их способностью соединяться друг с другом водородными связями. Биологическое значение воды:
1. Вода является превосходным растворителем для полярных веществ. Когда вещество переходит в раствор, его молекулы или ионы получают возможность двигаться более свободно и его реакционная способность возрастает. Поэтому в клетке большая часть химических реакций протекает в водных растворах. Неполярные вещества в водном растворе приобретают гидрофобность, не смешиваются с водой и потому могут разделять водные растворы на отдельные компартменты. Как растворитель вода служит средой для транспорта различных веществ.
2. Большая теплоемкость воды сводит к минимуму происходящие в ней температурные изменения. Существенное увеличение тепловой энергии вызывает лишь сравнительно небольшое повышение ее температуры, так как значительная часть этой энергии расходуется на разрыв водородных связей, ограничивающих подвижность молекул воды. Благодаря этому биохимические процессы протекают в меньшем интервале температур, то есть вода дает клеткам довольно значительное постоянство условий.
3. Большая теплота испарения из-за присутствия в воде водородных связей позволяет организмам охлаждаться при высоких температурах окружающей среды. Это используется у животных при потоотделении и одышке, у растений при транспирации листьев.
4. Большая теплота плавления (таяния льда) имеет и обратное свойство – при замерзании вода должна отдать большое количество тепловой энергии. Это уменьшает вероятность замерзания содержимого клеток и окружающей их жидкости.
5. Вода – единственное вещество, обладающее в жидком состоянии большей плотностью, чем в твердом. Плотность воды от +4оС до 0оС понижается, поэтому лед легче воды и в воде не тонет. Поскольку лед плавает в воде, он образуется при замерзании сначала на ее поверхности и покрывает толщу воды, как одеялом. Это повышает шансы на выживание у орга-низмов, обитающих в воде. Слои воды, температура которых упала ниже 4оС, поднимаются вверх, что обусловливает перемешивание воды в боль-ших водоемах, а вместе с водой циркулируют и питательные вещества. Находясь на поверхности, лед быстрее и тает.
6. У воды самое большое поверхностное натяжение из всех жидкостей, благодаря поверхностному натяжению жидкость стремится принять такую форму, чтобы площадь ее поверхности была минимальна. Это играет значительную роль в живых клетках и при движении воды по сосудам растений и животных.
7. Вода представляет собой один из необходимых метаболитов, например, используется в качестве источника водорода в процессе фотосинтеза и участвует в реакциях гидролиза.
Все вышеперечисленное привело к тому, что одним из главных факторов естественного отбора и образования новых видов является недостаток воды. Все наземные организмы приспособлены к тому, чтобы добывать и сберегать воду.
Из простых органических молекул синтезируются более крупные макромолекулы. Макромолекула – это гигантская молекула, построенная из многих повторяющихся единиц. Макромолекула представляет собой полимер, а звенья, из которых она состоит, называются мономерами. Существует три типа макромолекул: полисахариды, белки и нуклеиновые кислоты. Мономерами для них служат соответственно моносахариды, аминокислоты и нуклеотиды. Четвертым типом молекул являются липиды, они значительно меньше и не являются полимерами, но обычно объединяются друг с другом в значительно более крупные группы молекул с помощью гидрофобных взаимодействий.
Всем типам макромолекул присущи следующие общие свойства:
1) связи между субъединицами образуются путем удаления молекул воды (конденсацией);
2) для образования связей необходима энергия;
3) связи между субъединицами разрываются в результате присоединения молекул воды (гидролизом).
Ключевое различие между макромолекулами состоит в том, что нуклеиновые кислоты и белки могут рассматриваться как молекулы, несущие информацию, а полисахариды и липиды таковыми не являются. Это означает, что в белках и нуклеиновых кислотах важна последовательность мономерных звеньев, и в них она варьирует гораздо сильнее, чем в поли-сахаридах и липидах.
Ниже приведены наиболее часто встречающиеся в биомолекулах функциональные группы и соответствующие им названия групп соединений, которые необходимо знать для успешного владения биохимической терминологией.
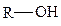 гидроксильная (спирты),
гидроксильная (спирты), 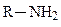 аминогруппа (амины),
аминогруппа (амины),
 альдегидная (альдегиды),
альдегидная (альдегиды), 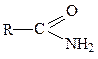 амидная (амиды),
амидная (амиды),
 карбонильная (кетоны),
карбонильная (кетоны), 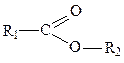 сложноэфирная,
сложноэфирная,
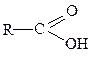 карбоксильная (кислоты),
карбоксильная (кислоты), 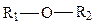 эфирная,
эфирная,
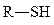 сульфгидрильная (тиолы),
сульфгидрильная (тиолы), 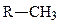 метильная,
метильная,
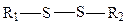 дисульфидная,
дисульфидная, 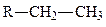 этильная,
этильная,
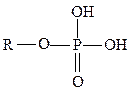 фосфатная,
фосфатная, 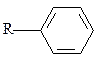 фенильная,
фенильная,
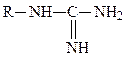 гуанидиновая,
гуанидиновая, 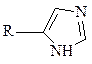 имидазольная.
имидазольная.
ЛЕКЦИЯ 2
Дата добавления: 2015-08-08; просмотров: 1509;
