ПРОСТЫЕ И СЛОЖНЫЕ БЕЛКИ
Простыми называются белки, которые при гидролизе распадаются только на аминокислоты. Название является достаточно условным, так как большая часть так называемых простых белков в клетках связаны с другими молекулами небелкового строения. Тем не менее традиционно выделяют следующие группы простых белков:
1. Гистоны – низкомолекулярные основные белки, участвуют в упаковке ДНК клетки, являются весьма консервативными белками, мутации в них гибельны. Выделяют пять фракций гистонов: фракция Н1 – богатые лизином, фракции Н2а и Н2б – умеренно богатые лизином, фракции Н3 и Н4 – богатые аргинином. Аминокислотная последовательность гистонов мало изменилась в процессе эволюции, гистоны млекопитающих, растений и дрожжей очень сходны друг с другом. Например, Н4 человека и пшеницы отличаются лишь несколькими аминокислотами, к тому же размер молекулы белка и ее полярность довольно постоянны. Из этого можно заключить, что гистоны были оптимизированы еще в эпоху общего предшественника животных, растений и грибов (более 700 млн лет назад). Хотя с тех пор в гистоновых генах происходили бесчисленные точечные мутации, все они, очевидно, приводили к вымиранию мутантных организмов.
2. Протамины – группа простейших низкомолекулярных белков, обладают выраженными основными свойствами за счет содержания 60–85% аргинина, хорошо растворимы в воде, являются аналогами гистонов, но более плотно упаковывают ДНК в сперматозоидах позвоночных, чтобы избежать разрывов при делении клеток.
3. Проламины – белки злаков, содержат 20–25% глутаминовой кислоты и 10–15% пролина, растворимы в 60–80% спирте, в то время как остальные белки в этих условиях выпадают в осадок. В проламинах почти полностью отсутствует лизин, что существенно снижает пищевую ценность растительных белков.
4. Глютеины – также белки растительного происхождения, составляют основную массу клейковины злаков.
5. Альбумины – белки крови, составляют больше половины белков крови, относятся к глобулярным белкам, растворимы в воде и слабых растворах солей, выпадают в осадок в насыщенном растворе (NH4)2SO4, изоэлектрическая точка – 4,7, имеют высокий отрицательный заряд при рН крови. Альбумин крови человека состоит из одной полипептидной цепи, включающей 584 аминокислотных остатков с повышенным содержанием аспарагиновой и глутаминовой кислот. В молекуле имеются три повторяющихся гомологичных домена, каждый из которых содержит шесть дисульфидных мостиков. Можно предположить, что в ходе эволюции ген, детерминирующий этот белок, дважды дуплицировался. Альбумин обусловливает основное осмотическое давление крови (его называют онкотическим) и обладает способностью связывать липофильные вещества, вследствие чего он может транспортировать жирные кислоты, билирубин, лекарственные вещества, некоторые стероидные гормоны, витамины, ионы кальция и магния. Альбумины существуют и в растительных клетках, там они характеризуются повышенным содержанием метионина и триптофана.
6. Глобулины – глобулярные белки плазмы крови, растворяются только в слабом растворе NaCl, в ненасыщенном растворе (NH4)2SO4 выпадают в осадок, в результате чего их можно отделить от альбуминов. Соотношение альбуминов и глобулинов – важная биохимическая характеристика крови, сохраняется на постоянном уровне. Глобулины при электрофорезе делят на несколько фракций:
α1 – антитрипсин, антихимотрипсин, протромбин, транскортин, переносящий кортикостероиды, переносчик прогестерона, тироксин-переносящий глобулин;
α2 – антитромбин, холинэстераза, плазминоген, макроглобулин, связывающий протеиназы и переносящий ионы цинка, ретинол-переносящий белок, витамин D-переносящий белок;
β – содержит трансферрин, переносящий железо, церулоплазмин, переносящий медь, фибриноген, глобулин, переносящий половые гормоны, транскобаламин, переносящий витамин В12, С-реактивный протеин, активирующий систему комплемента;
γ – фракция иммуноглобулинов.
Существуют также глобулины растений, они характеризуются повышенным содержанием аргинина, аспарагина и глутамина и состоят из двух фракций.
7. Склеропротеиды – белки, нерастворимые или ограниченно растворимые в воде, водных растворах нейтральных солей, этаноле и смесях этанола с водой. Это фибриллярные белки (кератины, коллаген, фиброин и др.), они отличаются высокой устойчивостью к химическим реактивам, действию протеолитических ферментов и выполняют в организме структурную функцию.
8. Токсические белки – токсины яда змей, скорпионов, пчел. Они характеризуются очень низкой молекулярной массой.
Сложные белки – это белки, при гидролизе распадающиеся на амино-кислоты и небелковое вещество. Если небелковое вещество прочно связано с белковым компонентом, то его называют простетической группой.
Сложные белки делятся на типы в зависимости от небелкового компонента.
Хромопротеиды – содержат в качестве простетической группы окрашенное вещество. Делят на три группы:
а) гемопротеиды (железопорфирины) – гемоглобин, миоглобин, цитохромы, каталаза, пероксидаза,
б) магнийпорфирины – хлорофилл,
в) флавопротеиды – ФАД и ФМН, входящие в состав оксидоредуктаз.
Металлопротеиды – содержат помимо белка ионы какого-либо одного или нескольких металлов. К ним относятся белки, содержащие негеминовое железо, а также белки, координационно связанные с атомами металлов в составе сложных белков-ферментов:
а) ферритин – высокомолекулярный водорастворимый сложный белок, содержащий около 20% железа, сосредоточен в селезенке, печени, костном мозге, выполняет роль депо железа в организме. Железо в ферритине находится в окисленной форме (FeO·OH)8·(FeO·PO3H2), причем атомы железа координационно связываются с атомами азота пептидных групп;
б) трансферрин – входит в состав фракции β-глобулинов, содержит 0,13% железа, является переносчиком железа в организме. Атом железа соединяется с белком координационными связями по гидроксильным группам тирозина.
Фосфопротеиды – белки, содержащие фосфорную кислоту, присоединенную сложноэфирной связью к гидроксильным радикалам серина и треонина. Содержание фосфорной кислоты достигает в фосфопротеидах 1%. Выполняют питательную функцию, запасая фосфор для построения костной и нервной ткани. Представителями фосфопротеидов являются:
а) вителлин – белок яичного желтка;
б) ихтулин – фосфопротеид икры рыб.
в) казеиноген – фосфопротеид молока, существует в виде растворимой соли с Са2+, при створаживании молока Са2+ отсоединяется и казеин выпадает в осадок;
Липопротеиды – белки, содержащие в качестве простетической группы нейтральные жиры, свободные жирные кислоты, фосфолипиды, холестериды. Липопротеиды входят в состав цитоплазматической мембраны и внутриклеточных мембран ядра, митохондрий, эндоплазматического ретикулума, а также присутствуют в свободном состоянии (в основном, в плазме крови). Липопротеиды стабилизируются нековалентными связями различной природы.
Липопротеиды плазмы крови имеют характерное строение: внутри находится жировая капля (ядро), содержащая неполярные липиды (триацилглицериды, этерифицированный холестерин); жировая капля окружена оболочкой, в состав которой входят фосфолипиды и свободный холестерин, полярные группы которых обращены к воде, а гидрофобные погружены в ядро; белковая часть представлена белками, называемыми апопротеинами. Апопротеины играют решающую роль в функционировании липопротеинов: они служат молекулами узнавания для мембранных рецепторов и необходимыми партнерами для ферментов и белков, которые участвуют в метаболизме и обмене липидов. Липопротеиды плазмы крови делят на несколько групп:
- хиломикроны (ХМ), осуществляют транспорт липидов из клеток кишечника в печень и ткани;
- пре-β-липопротеиды (липопротеиды очень низкой плотности – ЛПОНП), осуществляют транспорт липидов, синтезируемых в печени;
- β-липопротеиды (липопротеиды низкой плотности – ЛПНП), осуществляют транспорт холестерина в ткани;
- α-липопротеиды (липопротеиды высокой плотности – ЛПВП), осуществляют транспорт холестерина из тканей в печень, удаляют избыток холестерина из клеток, являются донором апопротеинов для остальных липопротеинов.
Чем больше липидное ядро, то есть чем большую часть составляют неполярные липиды, тем меньше плотность липопротеинового комплекса. Хиломикроны не могут проникать внутрь сосудистой стенки из-за своих больших размеров, а ЛПВП, ЛПНП и частично ЛПОНП могут. Однако ЛПВП из-за своего малого размера легче удаляются из стенки через лимфатическую систему, кроме того они имеют более высокий процент белка и фосфолипидов и метаболизируются быстрее, чем богатые холестерином и триацилглицеридами ЛПНП и ЛПОНП.
Гликопротеиды – содержат углеводы и их производные, прочно связанные с белковой частью молекулы. Углеводные компоненты, помимо информативной (иммунологической) функции, значительно повышают стабильность молекул к различного рода химическим, физическим воздействиям и предохраняют их от действия протеиназ. Гликозилированными чаще всего являются белки наружной стороны цитоплазматической мембраны и секретируемые из клетки белки. Связь между углеводным компонентом и белковой частью в разных гликопротеидах осуществляется посредством связи через одну из трех аминокислот: аспарагин, серин или треонин.
К гликопротеинам относятся все белки плазмы крови, кроме альбуминов, гликопротеиды цитоплазматической мембраны, некоторые ферменты, некоторые гормоны, гликопротеины слизистых оболочек, антифризы крови антарктических рыб.
Примером гликопротеинов являются иммуноглобулины – семейство Y-образных гликопротеинов, у которых обе вершины могут связывать антиген. Иммуноглобулины в организме находятся в виде мембранных белков на поверхности лимфоцитов и в свободном виде в плазме крови (антитела). Молекула IgG представляет собой крупный тетрамер из двух идентичных тяжелых цепей (Н-цепей) и двух идентичных легких цепей (L-цепей). В обеих Н-цепях имеется ковалентно связанный олигосахарид. Тяжелые цепи IgG состоят из четырех глобулярных доменов V, С1, С2, С3, легкие цепи – из двух глобулярных доменов V и С. Буква С обозначает константные области, V – вариабельные. Обе тяжелые цепи, а также тяжелая цепь с легкой, связаны дисульфидными мостиками. Домены внутри также стабилизированы дисульфидными мостиками. Домены имеют длину около 110 аминокислотных остатков и обладают взаимной гомологией. Такая структура, очевидно, возникла благодаря дупликации гена. В центральной области молекулы иммуноглобулина расположен шарнирный участок, который придает антителам внутримолекулярную подвижность. Иммуноглобулины расщепляются ферментом папаином на два Fab и один Fc-фрагмент. Оба Fab-фрагмента состоят из одной L-цепи и N-концевой части Н-цепи и сохраняют способность связывать антиген. Fc-фрагмент состоит из С-концевой половины обеих Н-цепей. Эта часть IgG выполняет функции связывания с клеточной поверхностью, взаимодействия с системой комплемента и участвует в переносе иммуноглобулинов клетками.
Гликофорин – гликопротеин мембраны эритроцитов, содержит около 50% углеводов в форме длинной полисахаридной цепи, ковалентно присоединенной к одному из концов полипептидной цепи. Углеводная цепь выступает наружу с внешней стороны мембраны, она содержит антигенные детерминанты, определяющие группу крови, кроме того, на ней имеются участки, связывающие некоторые патогенные вирусы. Полипептидная цепь погружена внутрь мембраны, расположенный в середине молекулы гликофорина гидрофобный пептидный участок проходит через липидный бислой, полярный конец с отрицательно заряженными остатками глутамата и аспартата погружен в цитоплазму.
Протеогликаны – отличаются от гликопротеидов соотношением углеводной и белковой части. В гликопротеидах крупная молекула белка в некоторых местах гликозилирована углеводными остатками, протеогликаны состоят из длинных углеводных цепей (95%), связанных с небольшим количеством белка (5%). Протеогликаны представляют собой основную субстанцию межклеточного матрикса соединительной ткани, их также называют гликозаминогликанами, мукополисахаридами. Углеводная часть представлена линейными неразветвленными полимерами, построенными из повторяющихся дисахаридных единиц, в их состав обязательно входят остатки мономера глюкозамина или галактозамина и D- или L-идуроновая кислота.
В состав протеогликанов входит 0,04% кремния, то есть на 130-280 повторяющихся звеньев животных протеогликанов приходится один атом этого элемента, у представителей растительного царства содержание кремния в пектинах примерно в пять раз выше. Предполагают, что ортокремниевая кислота Si(OH)4 реагирует с гидроксильными группами углеводов, в резуль-тате чего образуются эфирные связи, которые могут играть роль мостиков между цепями:

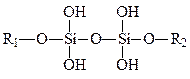
Отдельные представители протеогликанов:
1. Гиалуроновая кислота – очень широко распространенный протеогликан. Он присутствует в соединительной ткани животных, стекловидном теле глаза, в синовиальной жидкости суставов. Кроме того, она синтезируется различными бактериями. Основные функции гиалуроновой кислоты – связывание воды в межклеточном пространстве, удерживание клеток в желеподобном матриксе, смазочные свойства и способность смягчать удары, участие в регуляции проницаемости тканей. Доля белка – 1–2%. Дисахаридное звено состоит из остатка глюкуроновой кислоты и остатка N-ацетилглюкозамина, связанных β(1→3) гликозидной связью, между собой дисахаридные звенья соединены β(1→4) гликозидной связью. Благодаря присутствию β(1→3)-связей молекула гиалуроновой кислоты, насчитывающая несколько тысяч моносахаридных остатков, принимает конформацию спирали. На один виток спирали приходится три дисахаридных блока. Локализованные на внешней стороне спирали гидрофильные карбоксильные группы остатков глюкуроновой кислоты могут связывать ионы Са2+. За счет сильной гидратации этих групп гиалуроновая кислота и другие протеогликаны при образовании гелей связывают 10 000-кратный объем воды.
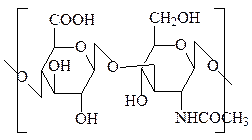
остаток глюкуроной кислоты + остаток N-ацетилглюкозамина
2. Хондроитинсульфаты – отличаются от гиалуроновой кислоты тем, что вместо N-ацетилглюкозамина в ней содержится N-ацетилгалактозамин-4(или 6)-сульфат. Хондроитин-4-сульфат локализован преимущественно в хрящах, костях, роговице глаза и хряще эмбриона. Хондроитин-6-сульфат – в коже, сухожилиях, связках, пупочном канатике, сердечных клапанах.
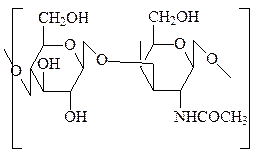
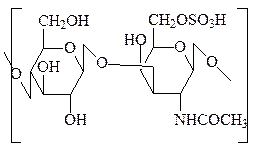
хондроитин-4-сульфат хондроитин-6-сульфат
3. Гепарин – антикоагулянт крови и лимфы млекопитающих, синтезируется тучными клетками, которые являются элементом соединительной ткани. С протеогликанами его объединяет химическая структура – дисахаридное звено состоит из остатка глюкуронат-2-сульфата и остатка N-ацетил-глюкозамин-6-сульфата. Существуют несколько видов гепаринов, немного отличающихся по строению. Гепарин очень прочно связан с белком. Углеводная цепь гепарина и хондроитинсульфатов присоединяется к белку через О-гликозидную связь, соединяющую конечный углеводный остаток и остаток серина белковой молекулы.
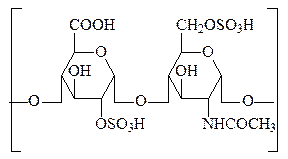
гепарин
4. Муреин – основной структурный полисахарид клеточных стенок бактерий. В муреине чередуются остатки двух различных моносахаридов, связанных в положении β(1→4): N-ацетилглюкозамина и характерной для муреина N-ацетилмурамовой кислоты. Последняя является простым эфиром молочной кислоты с N-ацетилглюкозамином. В клеточной стенке карбоксильная группа молочной кислоты связана амидной связью с пента-пептидом, который соединяет отдельные цепи муреина в трехмерную сетчатую структуру.

муреин
Нуклеопротеиды – сложные белки, в которых в роли небелковой части выступают нуклеиновые кислоты.
Несмотря на такое многообразие белков, существующее в клетках, природа на самом деле не перебирала все возможные сочетания аминокислот. Большинство белков произошло от ограниченного числа предковых генов.
Гомологичными называются белки, выполняющие у разных видов одинаковые функции, например, гемоглобин у всех позвоночных осуществляет транспорт кислорода, цитохром с во всех клетках участвует в процессах биологического окисления.
Гомологичные белки большинства видов:
а) имеют одинаковую или очень близкую молекулярную массу;
б) во многих положениях содержат одни и те же аминокислоты, называемые инвариантными остатками;
в) в некоторых положениях наблюдаются значительные различия в амино-кислотной последовательности, так называемые вариабельные области;
г) содержат гомологичные последовательности – совокупность сходных черт в аминокислотной последовательности сравниваемых белков; кроме идентичных аминокислот, эти последовательности содержат хотя и разные, но близкие по физико-химическим свойствам аминокислотные радикалы.
Сравнение аминокислотной последовательности гомологичных белков выявило:
1) консервативные, инвариантные аминокислотные остатки важны для формирования уникальной пространственной структуры и биологической функции данных белков;
2) наличие гомологичных белков говорит об общем эволюционном происхождении видов;
3) число вариабельных аминокислотных остатков в гомологичных белках пропорционально филогенетическим различиям между сравниваемыми видами;
4) в некоторых случаях даже небольшие изменения аминокислотной последовательности могут вызвать нарушения свойств и функций белков;
5) однако далеко не все изменения аминокислотной последовательности вызывают нарушения биологических функций белков;
6) наибольшие нарушения структуры и функции белков возникают при замене аминокислот входящих в ядро сворачивания белка, входящих в состав активного центра, на участках пересечения полипептидной цепи при образовании третичной структуры.
Белки, имеющие гомологичные участки полипептидной цепи, сходную конформацию и родственные функции, выделяют в семейства белков. Например, сериновые протеиназы – семейство белков, выполняющих функцию протеолитических ферментов. Некоторые аминокислотные замены привели к изменению субстратной специфичности этих белков и возникнове-нию функционального многообразия внутри семейства.
ЛЕКЦИЯ 8
Дата добавления: 2015-08-08; просмотров: 3243;
