АМИНОКИСЛОТЫ
Аминокислотами называются карбоновые кислоты, содержащие аминогруппу и карбоксильную группу. Природные аминокислоты являются 2-аминокарбоновыми кислотами, или α-аминокислотами, хотя существуют такие аминокислоты как β-аланин, таурин, γ-аминомасляная кислота. Обобщенная формула α-аминокислоты выглядит так:
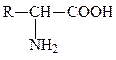
У α-аминокислот при 2 атоме углерода имеются четыре разных заместителя, то есть все α-аминокислоты, кроме глицина, имеют асимметрический (хиральный) атом углерода и существуют в виде двух энантиомеров – L- и D-аминокислот. Природные аминокислоты относятся к L-ряду. D-аминокислоты встречаются в бактериях и пептидных антибиотиках.
Все аминокислоты в водных растворах могут существовать в виде биполярных ионов, причем их суммарный заряд зависит от рН среды. Величина рН, при которой суммарный заряд равен нулю, называется изоэлектрической точкой. В изоэлектрической точке аминокислота является цвиттер-ионом, то есть аминная группа у нее протонирована, а карбоксиль-ная – диссоциирована. В нейтральной области рН большинство аминокислот являются цвиттер-ионами:
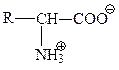
Аминокислоты не поглощают свет в видимой области спектра, ароматические аминокислоты поглощают свет в УФ области спектра: триптофан и тирозин при 280 нм, фенилаланин – при 260 нм.
Для аминокислот характерны некоторые химические реакции, имеющие большое значение для лабораторной практики: цветная нингидриновая проба на α-аминогруппу, реакции, характерные для сульфгидрильных, фенольных и других групп радикалов аминокислот, ацелирование и образование оснований Шиффа по аминогруппам, этерификация по карбоксильным группам.
Биологическая роль аминокислот:
1) являются структурными элементами пептидов и белков, так называемые протеиногенные аминокислоты. В состав белков входят 20 аминокислот, которые кодируются генетическим кодом и включаются в белки в про-цессе трансляции, некоторые из них могут быть фосфорилированы, ацилированы или гидроксилированы;
2) могут быть структурными элементами других природных соединений – коферментов, желчных кислот, антибиотиков;
3) являются сигнальными молекулами. Некоторые из аминокислот являются нейромедиаторами или предшественниками нейромедиаторов, гормонов и гистогормонов;
4) являются важнейшими метаболитами, например, некоторые аминокислоты являются предшественниками алкалоидов растений, или служат донорами азота, или являются жизненно важными компонентами питания.
Классификация протеиногенных аминокислот основана на строении и на полярности боковых цепей:
1. Алифатические аминокислоты:
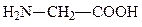 глицин, гли, G, Gly
глицин, гли, G, Gly
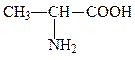 аланин, ала, А, Ala
аланин, ала, А, Ala
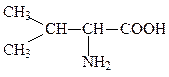 валин, вал, V, Val*
валин, вал, V, Val*
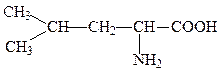 лейцин, лей, L, Leu*
лейцин, лей, L, Leu*
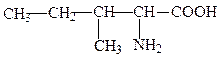 изолейцин, иле, I, Ile*
изолейцин, иле, I, Ile*
Эти аминокислоты не содержат в боковой цепи гетероатомов, циклических группировок и характеризуется отчетливо выраженной низкой полярностью.
2. Серосодержащие аминокислоты:
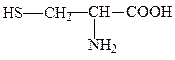 цистеин, цис, C, Cys
цистеин, цис, C, Cys
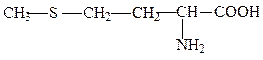 метионин, мет, M, Met*
метионин, мет, M, Met*
Серосодержащие аминокислоты также малополярны, причем цистеин существует лишь в недиссоциированном состоянии. Благодаря образованию дисульфидных мостиков, цистеин выполняет важную функцию стабилизации пространственной структуры белков.
3. Ароматические аминокислоты:
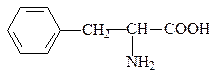 фенилаланин, фен, F, Phe*
фенилаланин, фен, F, Phe*
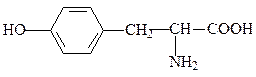 тирозин, тир, Y, Tyr
тирозин, тир, Y, Tyr
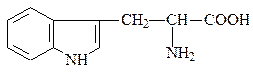 триптофан, три, W, Trp*
триптофан, три, W, Trp*
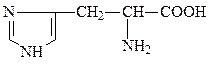 гистидин, гис, H, His
гистидин, гис, H, His
Ароматические аминокислоты содержат мезомерные резонансно стабилизированные циклы. В этой группе только аминокислота фенилаланин проявляет низкую полярность, тирозин и триптофан характеризуются заметной, а гистидин – даже высокой полярностью. Гистидин может быть отнесен также к основным аминокислотам.
4. Нейтральные аминокислоты:
 серин, сер, S, Ser
серин, сер, S, Ser
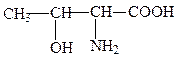 треонин, тре, T, Thr*
треонин, тре, T, Thr*
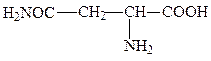 аспарагин, асн, N, Asn
аспарагин, асн, N, Asn
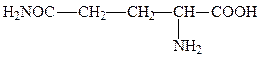 глутамин, глн,Q, Gln
глутамин, глн,Q, Gln
Нейтральные аминокислоты содержат гидроксильные или карбоксамидные группы. Хотя амидные группы неионогенны, молекулы аспарагина и глута-мина высоко полярны.
5. Кислые аминокислоты:
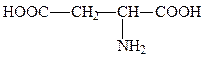 аспарагиновая кислота (аспартат), асп, D, Asp
аспарагиновая кислота (аспартат), асп, D, Asp
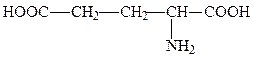 глутаминовая кислота (глутамат), глу, E, Glu
глутаминовая кислота (глутамат), глу, E, Glu
Карбоксильные группы боковых цепей кислых аминокислот полностью ионизированы во всем диапазоне физиологических значений рН.
6. Основные аминокислоты:
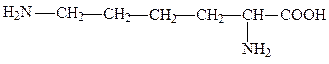 лизин, лиз, K, Lys*
лизин, лиз, K, Lys*
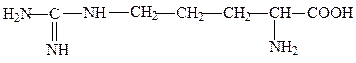 аргинин, арг, R, Arg
аргинин, арг, R, Arg
Боковые цепи основных аминокислот полностью протонированы в нейтраль-ной области рН. Сильно основной и очень полярной аминокислотой является аргинин, содержащий гуанидиновую группировку.
7. Иминокислота:
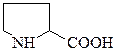 пролин, про, P, Pro
пролин, про, P, Pro
Боковая цепь пролина состоит из пятичленного цикла, включающего α-углеродный атом и α-аминогруппу. Поэтому пролин, строго говоря, является не амино-, а иминокислотой. Атом азота в кольце является слабым основанией и не протонируется при физиологических значениях рН. Благодаря циклической структуре пролин вызывает изгибы полипептидной цепи, что очень существенно для структуры коллагена.
Некоторые из перечисленных аминокислот не могут синтезироваться в организме человека и должны поступать вместе с пищей. Это незаменимые аминокислоты отмечены звездочками.
Как было указано выше, протеиногенные аминокислоты являются предшественниками некоторых ценных биологически активных молекул.
Два биогенных амина β-аланин и цистеамин входят в состав кофермента А (коферменты – производные водорастворимых витаминов, образующие активный центр сложных ферментов). β-Аланин образуется путем декарбоксилирования аспарагиновой кислоты, а цистеамин путем декарбоксилирования цистеина:
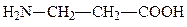 β-аланин
β-аланин 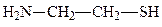 цистеамин
цистеамин
Остаток глутаминовой кислоты входит в состав другого кофермента – тетрагидрофолиевой кислоты, производного витамина Вс.
Другими биологически ценными молекулами являются конъюгаты желчных кислот с аминокислотой глицином. Эти конъюгаты являются более сильными кислотами, чем базовые, образуются в печени и присутствуют в желчи в виде солей.
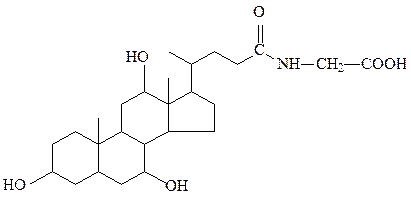 гликохолевая кислота
гликохолевая кислота
Протеиногенные аминокислоты являются предшественниками некоторых антибиотиков – биологически активных веществ, синтезируемых микроорганизмами и подавляющих размножение бактерий, вирусов и клеток. Наиболее известными из них являются пенициллины и цефалоспорины, составляющие группу β-лактамных антибиотиков и продуцирумые плесенью рода Penicillium. Для них характерно наличие в структуре реакционноспособного β-лактамного кольца, с помощью которого они ингибируют синтез клеточных стенок грамотрицательных микроорганизмов.
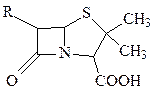 общая формула пенициллинов
общая формула пенициллинов
Из аминокислот путем декарбоксилирования получаются биогенные амины – нейромедиаторы, гормоны и гистогормоны.
Аминокислоты глицин и глутамат сами по себе являются нейромедиаторами в центральной нервной системе.
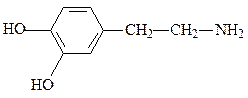
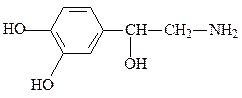
дофамин (нейромедиатор) норадреналин (нейромедиатор)
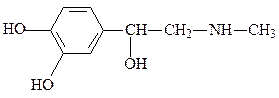
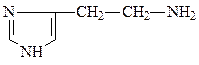
адреналин (гормон) гистамин (медиатор и гистогормон)
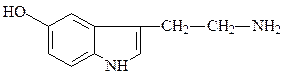
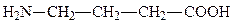
серотонин (нейромедиатор и гистогормон) ГАМК (нейромедиатор)
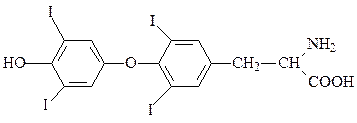 тироксин (гормон)
тироксин (гормон)
Производным аминокислоты триптофана является наиболее известный из встречающихся в природе ауксин – индолилуксусная кислота. Ауксины – это регуляторы роста растений, они стимулируют дифференцировку растущих тканей, рост камбия, корней, ускоряют рост плодов и опадение старых листьев, их антагонистами является абсцизовая кислота.
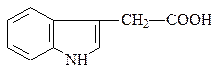 индолилуксусная кислота
индолилуксусная кислота
Производными аминокислот также являются алкалоиды – природные азотсодержащие соединения основного характера, образующиеся в расте-ниях. Данные соединения являются исключительно активными физиологическими соединениями, широко используемыми в медицине. Примерами алкалоидов могут служить производное фенилаланина папаверин, изохинолиновый алкалоид мака снотворного (спазмолитик), и производное триптофана физостигмин, индольный алкалоид из калабар-ских бобов (антихолинэстеразный препарат):

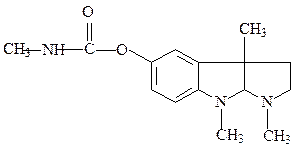
папаверин физостигмин
Аминокислоты являются чрезвычайно популярными объектами биотехнологии. Существует множество вариантов химического синтеза аминокислот, однако в результате получаются рацематы аминокислот. Так как для пищевой промышленности и медицины пригодны только L-изомеры аминокислот, рацемические смеси необходимо разделять на энантиомеры, что представляет серьезную проблему. Поэтому более популярен биотехнологический подход: ферментативный синтез с помощью иммобилизированных ферментов и микробиологический синтез с помощью целых микробных клеток. В обоих последних случаях получаются чистые L-изомеры.
Аминокислоты используются как пищевые добавки и компоненты кормов. Глутаминовая кислота усиливает вкус мяса, валин и лейцин улучшают вкус хлебобулочных изделий, глицин и цистеин используются в качестве антиоксидантов при консервировании. D-триптофан может быть заменителем сахара, так как во много раз его слаще. Лизин добавляют в корм сельскохозяйственным животным, так как большинство растительных белков содержит малое количество незаменимой аминокислоты лизина.
Аминокислоты широко используются в медицинской практике. Это такие аминокислоты как метионин, гистидин, глутаминовая и аспарагиновая кислоты, глицин, цистеин, валин.
В последнее десятилетие аминокислоты начали добавлять в космети-ческие средства по уходу за кожей и волосами.
Химически модифицированные аминокислоты также широко используются в промышленности в качестве поверхностно-активных веществ в синтезе полимеров, при производстве моющих средств, эмульгаторов, добавок к топливу.
ЛЕКЦИЯ 5
БЕЛКИ
Белки – это высокомолекулярные вещества, состоящие из аминокислот, соединенных пептидной связью.
Именно белки являются продуктом генетической информации, передаваемой из поколения в поколение, и осуществляют все процессы жизнедеятельности в клетке.
Функции белков:
1. Каталитическая функция. Наиболее многочисленную группу белков составляют ферменты – белки с каталитической активностью, ускоряющие химические реакции. Примерами ферментов являются пепсин, алкогольдегидрогеназа, глутаминсинтетаза.
2. Структурообразующая функция. Структурные белки отвечают за поддер-жание формы и стабильности клеток и тканей, к ним относятся кератины, коллаген, фиброин.
3. Транспортная функция. Транспортные белки переносят молекулы или ионы из одного органа в другой или через мембраны внутри клетки, например, гемоглобин, сывороточный альбумин, ионные каналы.
4. Защитная функция. Белки системы гомеостаза защищают организм от возбудителей болезней, чужеродной информации, потери крови – иммуноглобулины, фибриноген, тромбин.
5. Регуляторная функция. Белки осуществляют функции сигнальных веществ – некоторых гормонов, гистогормонов и нейромедиаторов, являются рецепторами к сигнальным веществам любого строения, обеспечивают дальнейшую передачу сигнала в биохимических сигнальных цепях клетки. Примерами могут служить гормон роста соматотропин, гормон инсулин, Н- и М-холинорецепторы.
6. Двигательная функция. С помощью белков осуществляются процессы сокращения и другого биологического движения. Примерами могут служить тубулин, актин, миозин.
7. Запасная функция. В растениях содержатся запасные белки, являющиеся ценными пищевыми веществами, в организмах животных мышечные белки служат резервными питательными веществами, которые мобилизуются при крайней необходимости.
Для белков характерным является наличие нескольких уровней структурной организации.
Первичной структурой белка называют последовательность аминокислотных остатков в полипептидной цепи. Пептидная связь – это карбоксамидная связь между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой аминокислоты.
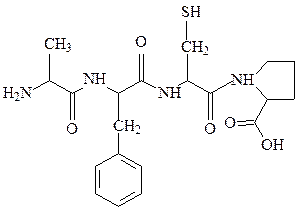 аланилфенилаланилцистеилпролин
аланилфенилаланилцистеилпролин
У пептидной связи есть несколько особенностей:
а) она резонансно стабилизирована и поэтому находится практически в одной плоскости – планарна; вращение вокруг связи С-N требует больших затрат энергии и затруднено;
б) у связи -CO-NH- особый характер, она меньше, чем обычная, но больше, чем двойная, то есть существует кето-енольная таутомерия:
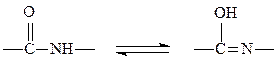
в) заместители по отношению к пептидной связи находятся в транс-положении;
г) пептидный остов окружен разнообразными по своей природе боковыми цепями, взаимодействуя с окружающими молекулами растворителя, свободные карбоксильные и аминогруппы ионизируются, образуя катионные и анионные центры молекулы белка. В зависимости от их соотношения белковая молекула получает суммарный положительный или отрицательный заряд, а также характеризуется тем или иным значением рН среды при достижении изоэлектрической точки белка. Радикалы образуют солевые, эфирные, дисульфидные мостики внутри молекулы белка, а также определяют круг реакций, свойственных белкам.
В настоящее время условились считать белками полимеры, состоящие из 100 и более аминокислотных остатков, полипептидами – полимеры, состоящие из 50-100 аминокислотных остатков, низкомолекулярными пептидами – полимеры, состоящие из менее 50 аминокислотных остатков.
Некоторые низкомолекулярные пептиды играют самостоятельную биологическую роль. Примеры некоторых таких пептидов:
Глутатион – γ-глу-цис-гли – один из наиболее широко распространен-ных внутриклеточных пептидов, принимает участие в окислительно-восстановительных процессах в клетках и переносе аминокислот через биологические мембраны.
Карнозин – β-ала-гис – пептид, содержащийся в мышцах животных, устраняет продукты перекисного расщепления липидов, ускоряет процесс распада углеводов в мышцах и в виде фосфата вовлекается в энергетический обмен в мышцах.
Вазопрессин – гормон задней доли гипофиза, участвующий в регуля-ции водного обмена организма:

Фаллоидин – ядовитый полипептид мухомора, в ничтожных концентрациях вызывает гибель организма вследствие выхода ферментов и ионов калия из клеток:
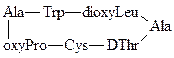
Грамицидин – антибиотик, действующий на многие грамположительные бактерии, изменяет проницаемость биологических мембран для низкомолекулярных соединений и вызывает гибель клеток:
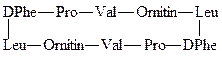
Мет-энкефалин – тир-гли-гли-фен-мет – пептид, синтезирующийся в нейронах и ослабляющий болевые ощущения.
Вторичная структура белка– это пространственная структура, образующаяся в результате взаимодействий между функциональными группами пептидного остова.
Пептидная цепь содержит множество СО- и NH-групп пептидных связей, каждая из которых потенциально способна участвовать в образовании водородных связей. Существуют два главных типа структур, которые позволяют это осуществить: α-спираль, в которую цепь свертывается как шнур от телефонной трубки, и складчатая β-структура, в которой бок о бок уложены вытянутые участки одной или нескольких цепей. Обе эти структуры весьма стабильны.
α-Спираль характеризуется предельно плотной упаковкой скрученной полипептидной цепи, на каждый виток правозакрученной спирали приходится 3,6 аминокислотных остатка, радикалы которых направлены всегда наружу и немного назад, то есть в начало полипептидной цепи.
Основные характеристики α-спирали:
1) α-спираль стабилизируется водородными связями между атомом водорода при азоте пептидной группы и карбонильным кислородом остатка, отстоящего от данного вдоль цепи на четыре позиции;
2) в образовании водородной связи участвуют все пептидные группы, это обеспечивает максимальную стабильность α-спирали;
3) в образовании водородных связей вовлечены все атомы азота и кислорода пептидных групп, что в значительной мере снижает гидрофильность α-спиральных областей и увеличивает их гидрофобность;
4) α-спираль образуется самопроизвольно и является наиболее устойчивой конформацией полипептидной цепи, отвечающей минимуму свободной энергии;
5) в полипептидной цепи из L-аминокислот правая спираль, обычно обнаруживаемая в белках, намного стабильнее левой.
Возможность образования α-спирали обусловлена первичной структурой белка. Некоторые аминокислоты препятствуют закручиванию пептидного остова. Например, расположенные рядом карбоксильные группы глутамата и аспартата взаимно отталкиваются друг от друга, что препятствует образованию водородных связей в α-спирали. По этой же причине затруднена спирализация цепи в местах близко расположенных друг к другу положительно заряженных остатков лизина и аргинина. Однако наибольшую роль в нарушении α-спирали играет пролин. Во-первых, в пролине атом азота входит в состав жесткого кольца, что препятствует вращению вокруг связи N-C, во-вторых, пролин не образует водородную связь из-за отсутствия водорода при атоме азота.
β-складчатость – это слоистая структура, образуемая водородными связями между линейно расположенными пептидными фрагментами. Обе цепи могут быть независимыми или принадлежать одной молекуле полипептида. Если цепи ориентированы в одном направлении, то такая β-структура называется параллельной. В случае противоположного направления цепей, то есть когда N-конец одной цепи совпадает с С-концом другой цепи, β-структура называется антипараллельной. Энергетически более предпочтительна антипараллельная β-складчатость с почти линейными водородными мостиками.

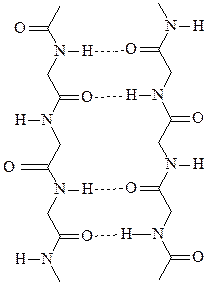
параллельная β-складчатость антипараллельная β-складчатость
В отличие от α-спирали, насыщенной водородными связями, каждый участок цепи β-складчатости открыт для образования дополнительных водородных связей. Боковые радикалы аминокислот ориентированы почти перпендикулярно плоскости листа попеременно вверх и вниз.
В тех участках, где пептидная цепь изгибается достаточно круто, часто находится β-петля. Это короткий фрагмент, в котором 4 аминокислотных остатка изгибаются на 180о и стабилизируются одним водородным мостиком между первым и четвертым остатками. Большие аминокислотные радикалы мешают образованию β-петли, поэтому в нее чаще всего входит самая маленькая аминокислота глицин.
Надвторичная структура белка – это некоторый специфический порядок чередования вторичных структур. Под доменом понимают обособленную часть молекулы белка, обладающую в определенной степени структурной и функциональной автономией. Сейчас домены считают фундаментальными элементами структуры белковых молекул и соотношение и характер компоновки α-спиралей и β-слоев дает для понимания эволюции белковых молекул и филогенетических связей больше, чем сопоставление первичных структур. Главной задачей эволюции является конструирование все новых белков. Бесконечно мал шанс случайно синтезировать такую аминокислотную последовательность, которая бы удовлетворила условиям упаковки и обеспечила выполнение функциональных задач. Поэтому часто встречаются белки с различной функцией, но сходные по структуре настолько, что кажется, что они имели одного общего предка или произошли друг от друга. Похоже, что эволюция, столкнувшись с необходимостью решить определенную задачу, предпочитает не конструировать для этого белки сначала, а приспособить для этого уже хорошо отлаженные структуры, адаптируя их для новых целей.
Некоторые примеры часто повторяющихся надвторичных структур:
1) αα’ – белки, содержащие только α-спирали (миоглобин, гемоглобин);
2) ββ’ – белки, содержащие только β-структуры (иммуноглобулины, супероксиддисмутаза);
3) βαβ’ – структура β-бочонка, каждый β-слой расположен внутри бочонка и связан с α-спиралью, находящейся на поверхности молекулы (триозофосфоизомераза, лактатдегидрогеназа);
4) «цинковый палец» – фрагмент белка, состоящий из 20 аминокислотных остатков, атом цинка связан с двумя остатками цистеина и двумя гистидина, в результате чего образуется «палец» из примерно 12 амино-кислотных остатков, может связываться с регуляторными участками молекулы ДНК;
5) «лейциновая застежка-молния» – взаимодействующие белки имеют α-спиральный участок, содержащий по крайней мере 4 остатка лейцина, они расположены через 6 аминокислот один от другого, то есть находятся на поверхности каждого второго витка и могут образовывать гидрофобные связи с лейциновыми остатками другого белка. С помощью лейциновых застежек, например, молекулы сильноосновных белков гистонов могут объединяться в комплексы, преодолевая положительный заряд.
Третичная структура белка – это пространственное расположение молекулы белка, стабилизируемое связями между боковыми радикалами аминокислот.
Типы связей, стабилизирующих третичную структуру белка:
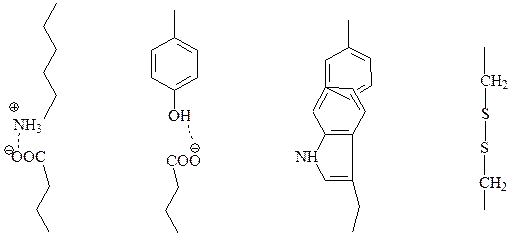
электростатическое водородные гидрофобные дисульфидные
взаимодействие связи взаимодействия связи
В зависимости от складывания третичной структуры белки можно классифицировать на два основных типа – фибриллярные и глобулярные.
Фибриллярные белки – нерастворимые в воде длинные нитевидные молекулы, полипептидные цепи которых вытянуты вдоль одной оси. В основном это структурные и сократительные белки. Несколько примеров самых распространенных фибриллярных белков:
1. α-Кератины. Синтезируются клетками эпидермиса. На их долю приходится почти весь сухой вес волос, шерсти, перьев, рогов, ногтей, когтей, игл, чешуи, копыт и черепашьего панциря, а также значительная часть веса наружного слоя кожи. Это целое семейство белков, они сходны по аминокислотному составу, содержат много остатков цистеина и имеют одинаковое пространственное расположение полипептидных цепей. В клетках волос полипептидные цепи кератина сначала организуются в волокна, из которых затем формируются структуры наподобие каната или скрученного кабеля, заполняющего в конце концов все пространство клетки. Клетки волос становятся при этом уплощенными и, наконец, отмирают, а клеточные стенки образуют вокруг каждого волоса трубчатый чехол, называемый кутикулой. В α-кератине полипептидные цепи имеют форму α-спирали, скручены одна вокруг другой в трехжильный кабель с образованием поперечных дисульфидных связей. N-концевые остатки расположены с одной стороны (параллельны). Кератины нерастворимы в воде из-за преобладания в их составе аминокислот с неполярными боковыми радикалами, которые обращены в сторону водной фазы. При химической завивке происходят следующие процессы: вначале путем восстановления тиолами разрушаются дисульфидные мостики, а затем при придании волосам необходимой формы их высушивают нагреванием, при этом за счет окисления кислородом воздуха образуются новые дисульфидные мостики, которые сохраняют форму прически.
2. β-Кератины. К ним относятся фиброин шелка и паутины. Представляют из себя антипараллельные β-складчатые слои с преобладанием глицина, аланина и серина в составе.
3. Коллаген. Самый распространенный белок у высших животных и главный фибриллярный белок соединительных тканей. Коллаген синтезируется в фибробластах и хондроцитах – специализированных клетках соединительной ткани, из которых затем выталкивается. Коллагеновые волокна находятся в коже, сухожилиях, хрящах и костях. Они не растяги-ваются, по прочности превосходят стальную проволоку, коллагеновые фибриллы характеризуются поперечной исчерченностью. При кипячении в воде волокнистый, нерастворимый и неперевариваемый коллаген превращается в желатин в результате гидролиза некоторых ковалентных связей. Коллаген содержит 35% глицина, 11% аланина, 21% пролина и 4-гидроксипролина (аминокислоты, свойственной только для коллагена и эластина). Такой состав определяет относительно низкую питательную ценность желатина как пищевого белка. Фибриллы коллагена состоят из повторяющихся полипептидных субъединиц, называемых тропоколлагеном. Эти субъединицы уложены вдоль фибриллы в виде параллельных пучков по типу «голова к хвосту». Сдвинутость головок и придает характерную поперечную исчерченность. Пустоты в этой структуре при необходимости могут служить местом отложения кристаллов гидроксиапатита Са5(ОН)(РО4)3, играющего важную роль в минерализации костей.
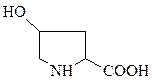
Тропоколлагеновые субъединицы состоят из трех полипептидных цепей, плотно скрученных в виде трехжильного каната, отличающегося от α- и β-кератинов. В одних коллагенах все три цепи имеют одинаковую аминокислотную последовательность, тогда как в других идентичны только две цепи, а третья отличается от них. Полипептидная цепь тропоколлагена образует левую спираль, на один виток которой приходится только три аминокислотных остатка из-за изгибов цепи, обусловленной пролином и гидроксипролином. Три цепи связаны между собой кроме водородных связей связью ковалентного типа, образующейся между двумя остатками лизина, находящимися в соседних цепях:

По мере того как мы становимся старше, в тропоколлагеновых субъединицах и между ними образуется все большее число поперечных связей, что делает фибриллы коллагена более жесткими и хрупкими, и это изменяет механические свойства хрящей и сухожилий, делает более ломкими кости и понижает прозрачность роговицы глаза.
4. Эластин. Содержится в желтой эластичной ткани связок и эластическом слое соединительной ткани в стенках крупных артерий. Основная субъединица фибрилл эластина – тропоэластин. Эластин богат глицином и аланином, содержит много лизина и мало пролина. Спиральные участки эластина растягиваются при натяжении, но возвращаются при снятии нагрузки к исходной длине. Остатки лизина четырех разных цепей образуют ковалентные связи между собой и позволяют эластину обратимо растягиваться во всех направлениях.
Глобулярные белки – белки, полипептидная цепь которых свернута в компактную глобулу, способны выполнять самые разнообразные функции.
Третичную структуру глобулярных белков удобнее всего рассмотреть на примере миоглобина. Миоглобин – это относительно небольшой кислород-связывающий белок, присутствующий в мышечных клетках. Он запасает связанный кислород и способствует его переносу в митохондрии. В молекуле миоглобина находится одна полипептидная цепь и одна гемогруппа (гем) – комплекс протопорфирина с железом. Основные свойства миоглобина:
а) молекула миоглобина настолько компактна, что внутри нее может уместиться всего 4 молекулы воды;
б) все полярные аминокислотные остатки, за исключением двух, расположены на внешней поверхности молекулы, причем все они находятся в гидратированном состоянии;
в) большая часть гидрофобных аминокислотных остатков расположена внутри молекулы миоглобина и, таким образом, защищена от соприкосно-вения с водой;
г) каждый из четырех остатков пролина в молекуле миоглобина находится в месте изгиба полипептидной цепи, в других местах изгиба расположены остатки серина, треонина и аспарагина, так как такие аминокислоты препятствуют образованию α-спирали, если находятся друг с другом;
д) плоская гемогруппа лежит в полости (кармане) вблизи поверхности молекулы, атом железа имеет две координационные связи, направленные перпендикулярно плоскости гемма, одна из них связана с остатком гистидина 93, а другая служит для связывания молекулы кислорода.
Начиная с третичной структуры белок становится способным выполнять свойственные ему биологические функции. В основе функционирования белков лежит то, что при укладке третичной структуры на поверхности белка образуются участки, которые могут присоединять к себе другие молекулы, называемые лигандами. Высокая специфичность взаимодействия белка с лигандом обеспечивается комплементарностью структуры активного центра структуре лиганда. Комплементарность – это пространственное и химическое соответствие взаимодействующих поверхностей. Для большей части белков третичная структура – максимальный уровень укладки.
Четвертичная структура белка – характерна для белков, состоящих из двух и более полипептидных цепей, связанных между собой исключительно нековалентными связями, в основном электростатическими и водородными. Чаще всего белки содержат две или четыре субъединицы, более четырех субъединиц обычно содержат регуляторные белки.
Белки, имеющие четвертичную структуру, часто называются олигомерными. Различают гомомерные и гетеромерные белки. К гомо-мерным относятся белки, у которых все субъединицы имеют одинаковое строение, например, фермент каталаза состоит их четырех абсолютно одинаковых субъединиц. Гетеромерные белки имеют разные субъединицы, например, фермент РНК-полимераза состоит из пяти разных по строению субъединиц, выполняющих разные функции.
Взаимодействие одной субъединицы со специфическим лигандом вызывает конформационные изменения всего олигомерного белка и изменяет сродство других субъединиц к лигандам, это свойство лежит в основе способности олигомерных белков к аллостерической регуляции.
Четвертичную структуру белка можно рассмотреть на примере гемоглобина. Содержит четыре полипептидных цепи и четыре простетические группы гема, в которых атомы железа находятся в закисной форме Fe2+. Белковая часть молекулы – глобин – состоит из двух α-цепей и двух β-цепей, содержащих до 70% α-спиралей. Каждая из четырех цепей имеет характерную для нее третичную структуру, с каждой цепью связана одна гемогруппа. Гемы разных цепей сравнительно далеко расположены друг от друга и имеют разный угол наклона. Между двумя α-цепями и двумя β-цепями образуется мало прямых контактов, тогда как между α- и β-цепями возникают многочисленные контакты типа α1β1 и α2β2, образованные гидрофобными радикалами. Между α1β1 и α2β2 остается канал.
В отличие от миоглобина гемоглобин характеризуется значительно более низким сродством к кислороду, что позволяет ему при существующих в тканях низких парциальных давлениях кислорода отдавать им значительную часть связанного кислорода. Кислород легче связывается железом гемоглобина при более высоких значениях рН и низкой концентрации СО2, свойственные альвеолам легких; освобождению кислорода из гемоглобина благоприятствуют более низкие значения рН и высокие концентрации СО2, свойственные тканям.
Кроме кислорода гемоглобин переносит ионы водорода, которые связываются с остатками гистидина в цепях. Также гемоглобин переносит углекислый газ, который присоединяет к концевой аминогруппе каждой из четырех полипептидных цепей, в результате чего образуется карбаминогемоглобин:

В эритроцитах в достаточно больших концентрациях присутствует вещество 2,3-дифосфоглицерат (ДФГ), его содержание увеличивается при подъеме на большую высоту и при гипоксии, облегчая высвобождение кислорода из гемоглобина в тканях. ДФГ располагается в канале между α1β1 и α2β2, взаимодействуя с положительно зараженными группами β-цепей. При связывании гемоглобином кислорода ДФГ вытесняется из полости. В эритроцитах некоторых птиц содержится не ДФГ, а инозитолгекса-фосфат, который еще больше снижает сродство гемоглобина к кислороду.
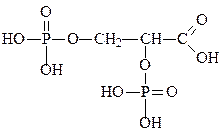 2,3-дифосфоглицерат (ДФГ)
2,3-дифосфоглицерат (ДФГ)
HbA – нормальный гемоглобин взрослого человека, HbF – фетальный гемоглобин, имеет большее сродство к О2, HbS – гемоглобин при серповидноклеточной анемии. Серповидноклеточная анемия – это серьезное наследственное заболевание, связанное с генетической аномалией гемоглобина. В крови больных людей наблюдается необычно большое количество тонких серповидных эритроцитов, которые, во-первых, легко разрываются, во-вторых, закупоривают кровеносные капилляры. На молеку-лярном уровне гемоглобин S отличается от гемоглобина А по одному аминокислотному остатку в положении 6 β-цепей, где вместо остатка глутаминовой кислоты находится валин. Таким образом, гемоглобин S содержит на два отрицательных заряда меньше, появление валина приводит к возникновению «липкого» гидрофобного контакта на поверхности молекулы, в результате при дезоксигенации молекулы дезоксигемоглобина S слипаются и образуют нерастворимые аномально длинные нитевидные агрегаты, приводящие к деформации эритроцитов.
Нет никаких оснований думать, что существует независимый генетический контроль за формированием уровней структурной организации белка выше первичного, поскольку первичная структура определяет и вторичную, и третичную, и четвертичную (если она имеется). Нативной конформацией белка является термодинамически наиболее устойчивая в данных условиях структура.
ЛЕКЦИЯ 6
Дата добавления: 2015-08-08; просмотров: 7368;
