Электрохимия и окислительно-восстановительные реакции
В гальваническом элементе можно измерить электродные потенциалы полуреакций относительно стандартного электрода.
Например: MnO4– + e = MnO42– ;
В таблицах приведены стандартные электродные потенциалы для полуреакций восстановления: 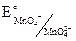 = +0,56В. Значение электродного потенциала при восстановлении равно его значению при окислении.
= +0,56В. Значение электродного потенциала при восстановлении равно его значению при окислении.
Пример:
2KMnO4 + 2NaOH + Na2SO3 = K2MnO4 + Na2MnO4 + NaSO4 + H2O

 2 MnO4– + e = MnO42– восстановление
2 MnO4– + e = MnO42– восстановление
MnO4– – окислитель
1 SO32– + 2OH– – 2e = SO42– + H2O окисление
 SO32– – восстановитель
SO32– – восстановитель
2MnO4– + SO32– + 2OH– = 2MnO42– + SO42– + H2O
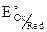 =
= 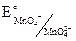 = + 0,56B,
= + 0,56B, 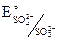 = – 0,93В.
= – 0,93В.
Вещества, обладающие более положительным или менее отрицательным электродным потенциалом, являются окислителями, вещества с менее положительным или более отрицательным потенциалом являются восстановителями.
Если эту реакцию проводить в гальваническом элементе, то работа гальванического элемента определяется так: Amax = nFDE, где DE = EK – EA . На катоде происходит восстановление окислителя, значит, Ек = Еокисл., соответственно, Еа= Евосстан.
DE = Eокисл. – Eвосстан. = 0,56 + 0,93 =1,49В.
Работа происходит за счёт убыли свободной энергии, следовательно:
Amax = – DG; DG = - nFDE .
Если при этом DE > 0, то DG < 0 – условие самопроизвольности окислительно-восстановительного процесса. DE > 0 если Eокисл. > Eвосстан., т.о. самопроизвольность протекания процесса можно определить без проведения реакции.
Рассмотрим влияние среды на значение электродного потенциала.
Напишем уравнение Нернста для данной реакции:
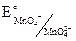 = E° +
= E° + 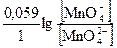 =
= 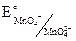 + 0,059(lg[MnO4–] – lg[MnO42–])
+ 0,059(lg[MnO4–] – lg[MnO42–])
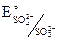 = E° +
= E° + 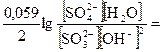 E° +
E° + 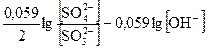 .
.
Вывод: чем больше концентрация гидроксила, тем легче пойдёт окисление SO32– в SO42– , т.к. потенциал восстановителя понижается при увеличении концентрации ионов гидроксила, при этом увеличивается DЕ.
Рассмотрим влияние кислой среды:
KMnO4 + KNO2 + H2SO4 = 2MnSO4 + 5KNO3 + 3H2O + K2SO4

 2 MnO4– + 8H+ + 5e = Mn2+ + 4H2O восстановление
2 MnO4– + 8H+ + 5e = Mn2+ + 4H2O восстановление
MnO4– – окислитель
5 NO2– + H2O – 2e = NO3– + 2H+ окисление
NO2– – восстановитель

2MnO4– + 16H+ + 5NO2– + 5H2O = 2Mn2+ + 8H2O + 5NO3– + 10H+
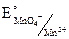 = 1,23 B = Eокисл.
= 1,23 B = Eокисл.
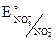 = 0,8 В = Евосст. DE = 0,43 В > 0, DG < 0.
= 0,8 В = Евосст. DE = 0,43 В > 0, DG < 0.
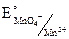 = E° +
= E° + 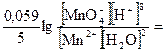 E° +
E° + 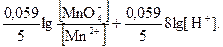
Вывод: чем больше концентрация ионов водорода, тем большими окислительными свойствами обладает перманганат - ион
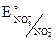 = E° +
= E° + 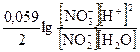 = E° +
= E° + 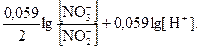
Таким образом, при определённых условиях (в присутствии более сильного окислителя) нитрит-анион может быть восстановителем, а может выступать и в качестве окислителя в кислой среде, т.к. повышение кислотности среды повышает электродный потенциал нитрит-аниона.
Дата добавления: 2015-08-08; просмотров: 796;
