Химические свойства металлов.
Металлы занимают в Периодической таблице левый нижний угол. Металлы относятся к семействам s – элементов, d – элементов, f-элементов и частично – р-элементов.
Самым типичным свойством металлов является их способность отдавать электроны и переходить в положительно заряженные ионы. Причём металлы могут проявлять только положительную степень окисления.
Ме – ne = Men+
1. Взаимодействие металлов с неметаллами.
а). Взаимодействие металлов с водородом.
С водородом непосредственно реагируют щелочные и щелочноземельные металлы, образуя гидриды. Например:
2Na + H2 = NaH
Ca + H2 = CaH2
Образуются нестехиометрические соединения с ионной кристаллической структурой.
б). Взаимодействие металлов с кислородом.
Все металлы за исключением Au, Ag, Pt окисляются кислородом воздуха. Пример:
2Na + O2 = Na2O2 (пероксид)
4K + O2 = 2K2O
2Mg + O2 = 2MgO
2Cu + O2 = 2CuO
в). Взаимодействие металлов с галогенами.
Все металлы реагируют с галогенами с образованием галогенидов. Пример:
2Al + 3Br2 = 2AlBr3
В основном это ионные соединения: MeHaln
г). Взаимодействие металлов с азотом.
С азотом взаимодействуют щелочные и щелочноземельные металлы. Пример:
3Ca + N2 = Ca3N2
Mg + N2 = Mg3N2 – нитрид.
д). Взаимодействие металлов с углеродом.
Соединения металлов и углерода – карбиды. Они образуются при взаимодействии расплавов с углеродом. Активные металлы образуют с углеродом стехиометрические соединения:
4Al + 3C = Al4C3
Металлы – d-элементы образуют соединения нестехиометрического состава типа твердых растворов: WC, ZnC, TiC – используются для получения сверхтвёрдых сталей.
2. Взаимодействие металлов с водой.
С водой реагируют металлы, имеющие более отрицательный потенциал, чем окислительно-восстановительный потенциал воды. 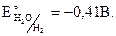
Активные металлы более активно реагируют с водой, разлагая воду с выделением водорода.
Na + 2H2O = H2↑ + 2NaOH
Менее активные металлы медленно разлагают воду и процесс тормозится из-за образования нерастворимых веществ.
3. Взаимодействие металлов с растворами солей.
Такая реакция возможна, если реагирующий металл активнее, чем находящийся в соли:
Zn + CuSO4= Cu0↓ + ZnSO4
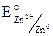 = – 0,76 B.,
= – 0,76 B., 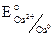 = + 0,34 B.
= + 0,34 B.
Металл, обладающий более отрицательным или менее положительным стандартным электродным потенциалом, вытесняет другой металл из раствора его соли.
4. Взаимодействие металлов с растворами щелочей.
Со щелочами могут взаимодействовать металлы, дающие амфотерные гидрооксиды или обладающие высокими степенями окисления в присутствии сильных окислителей. При взаимодействии металлов с растворами щелочей, окислителем является вода.
Пример:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑

 1 Zn0 + 4OH– – 2e = [Zn(OH)4]2– окисление
1 Zn0 + 4OH– – 2e = [Zn(OH)4]2– окисление
Zn0 – восстановитель
1 2H2O + 2e = H2 + 2OH– восстановление
 H2O – окислитель
H2O – окислитель
Zn + 4OH– + 2H2O = [Zn(OH)4]2– + 2OH– + H2↑
Металлы, обладающие высокими степенями окисления, могут взаимодействовать со щелочами при сплавлении:
4Nb +5O2 +12KOH = 4K3NbO4 + 6H2O
5. Взаимодействие металлов с кислотами.
Это сложные реакции, продукты взаимодействия зависят от активности металла, от вида и концентрации кислоты и от температуры.
По активности металлы условно делятся на активные, средней активности и малоактивные.
Кислоты условно делятся на 2 группы:
I группа – кислоты, обладающие невысокой окислительной способностью: HCl, HI, HBr, H2SO4(разб.), H3PO4, H2S, окислитель здесь H+. При взаимодействии с металлами выделяется кислород (H2↑). С кислотами первой группы реагируют металлы, обладающие отрицательным электродным потенциалом.
II группа – кислоты, обладающие высокой окислительной способностью: H2SO4(конц.), HNO3(разб.), HNO3(конц.). В этих кислотах окислителями являются анионы кислоты: 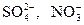 . Продукты восстановления аниона могут быть самыми разнообразными и зависят от активности металла.
. Продукты восстановления аниона могут быть самыми разнообразными и зависят от активности металла.
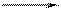 H2S↑ – c активными металлами
H2S↑ – c активными металлами
6+ +8е
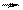 H2SO4 +6е S0↓ – с металлами средней активности
H2SO4 +6е S0↓ – с металлами средней активности
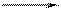 конц. +2е
конц. +2е
SO2↑ – c малоактивными металлами
 NH3 ( NH4NO3 )– c активными металлами
NH3 ( NH4NO3 )– c активными металлами
5+ +8e
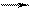
 HNO3 +4,5e N2O, N2 – с металлами средней активности
HNO3 +4,5e N2O, N2 – с металлами средней активности
разб.
+3e
NO – c малоактивными металлами
HNO3(конц.) – NO2↑ – c металлами любой активности.
Если металлы обладают переменной валентностью, то с кислотами I группы металлы приобретают низшую положительную степень окисления: Fe → Fe2+, Cr → Cr2+. При взаимодействии с кислотами II группы – степень окисления +3: Fe → Fe3+, Cr → Cr3+, при этом никогда не выделяется водород.
Некоторые металлы (Fe, Cr, Al, Ti, Ni и др.) в растворах сильных кислот, окисляясь, покрываются плотной оксидной плёнкой, которая защищает металл от дальнейшего растворения (пассивация), но при нагревании оксидная плёнка растворяется, и реакция идёт.
Малорастворимые металлы, обладающие положительным электродным потенциалом, могут растворяться в кислотах I группы, в присутствии сильных окислителей.
Дата добавления: 2015-08-08; просмотров: 716;
