Электродный потенциал водородного электрода.
2H+ + 2e = H2
Ox Red
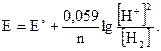 Если мы имеем дело с газами, то заменяем концентрацию парциальным давлением (P(H2) = 1атм.).
Если мы имеем дело с газами, то заменяем концентрацию парциальным давлением (P(H2) = 1атм.).
E = E° + 0,059 lg[H+]; Е° = 0; Е = 0,059 lg[H+] или Е = -0,059рН
В нейтральной среде:
[H+] = 10–7; Е = – 0,41В.
Стандартный электродный потенциал - это потенциал данного электродного процесса при Т = 298 К, р = 101325Па и концентрации всех участвующих веществ 1моль/л.
Понятие об электролизе.
Электролиз – электрохимический процесс, протекающий на электродах при наложении внешней разности потенциалов от сети, т. е. электролиз это не самопроизвольный процесс, он осуществляется за счёт подвода энергии извне (DG > 0).
Электрод, который подключён к отрицательному полюсу источника тока, называется катодом, электрод, который подключён к положительному полюсу – анодом.
Существуют различные виды электролиза, в том числе с растворимым и нерастворимым анодом.
1. Рассмотрим электролиз с нерастворимым анодом.
Нерастворимый анод выполняют из графита или платины. Рассмотрим электролиз раствора CuCl2, если электроды графитовые.
CuCl2 = Cu2+ + 2Cl–
При подключении источника тока, ионы приобретают направленное движение и протекают два процесса:
анодный процесс: 2Cl– – 2e = Cl2
катодный процесс: Cu2+ + 2e = Cu0
_______________________________
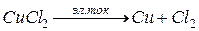
Роль источника тока заключается в перекачивании электронов с анода на катод. Таким образом, происходит электролиз раствора меди с нерастворимым электродом.
2. Рассмотрим электролиз с растворимым анодом. В качестве растворимого анода используют хром, никель, железо, серебро, медь и др.
Пример: CuCl2 = Cu2+ + 2Cl-, оба электрода выполнены из меди. Рассмотрим процессы, происходящие при электролизе:
анодный процесс: а) 2Cl– –2e = Cl2, при этом: 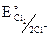 = + 1,358 В.
= + 1,358 В.
б) Cu – 2e = Cu2+, 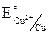 = + 0,34 В.
= + 0,34 В.
Электродный потенциал полуреакции б) ниже и, следовательно, будет преобладать этот процесс.
катодный процесс: Cu2+ + 2e = Cu0.
Электролиз с растворимым анодом часто используется для нанесения металлических покрытий на изделия из металла (хромирования, цинкования или никелирования металлов).
Рассмотрим никелирование металлического изделия. Для этого в качестве электролита используем NiSO4.
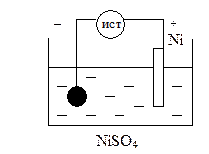
анодный процесс: Ni – 2e = Ni2+
катодный процесс: Ni2+ + 2e = Ni0
Электролиз с растворимым анодом используют для очистки металлов, в частности, черновую медь очищают, используя её в качестве анода (рафинирование металлов).
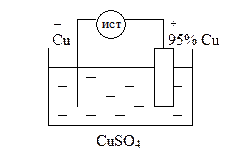
анодный процесс: Cu – 2e = Cu2+
катодный процесс: Cu2+ + 2e = Cu0
При электролизе водных растворов анодный и катодный процессы могут быть осложнены окислением или восстановлением молекул воды или ее ионов.
Например:
анодный процесс: 2H2O – 4e = 4H+ + O2
4OH– – 4e = 2H2O + O2
катодный процесс: 2H2O + 2e = H2↑ + 2OH–
2H+ + 2e = H2↑
Рассмотрим случай электролиза с участием воды:
MgCl2
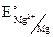 = – 2,37 В.
= – 2,37 В.
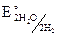 = – 0,41 В.
= – 0,41 В.
анодный процесс: 2Cl– –2e = Cl2
катодный процесс: Mg2+ + 2e = Mg0
2H2O + 2e = H2 + 2OH–
Сравнив электродные потенциалы полуреакций, выясняем, что будет преобладать процесс восстановления воды. Следовательно, катионы активных металлов не восстанавливаются при электролизе водных растворов. Катион аммония (NH4+) ведет себя как ионы щелочных металлов.
При электролизе водных растворов электролитов следует помнить, что в обычных условиях не происходит анодного окисления анионов кислородсодержащих кислот (NO3-, SO42- и др.). В этом случае происходит окисление воды.
Зависимость количества вещества, образовавшегося при электролизе, от времени и силы тока описывается обобщенным законом Фарадея:
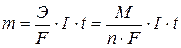 , где
, где
m - масса образовавшегося при электролизе вещества (г)
Э – эквивалентная масса вещества (г/моль)
М – молярная масса вещества (г/моль)
n – количество отдаваемых или принимаемых электронов
I – сила тока (А)
t – продолжительность процесса (с)
F – константа Фарадея, характеризующая количество электричества, необходимое для выделения 1 эквивалентной массы вещества (F = 96500 Кл/моль)
Дата добавления: 2015-08-08; просмотров: 1338;
