Основы электрохимии
При окислительно-восстановительных реакциях происходит переход электронов от восстановителя к окислителю, при этом один элемент окисляется, а другой восстанавливается. Можно проводить эту реакцию таким образом, чтобы процессы окисления и восстановления были пространственно разделены, а электроны перемещались от восстановителя к окислителю по внешней цепи. Такой направленный поток электронов называется электрическим током.
Устройства, при помощи которых химическая энергия превращается в электрическую, называются гальваническими элементами, или химическими источниками электрической энергии (ХИЭЭ).
Рассмотрим, например гальванический элемент Якоби – Даниэля:
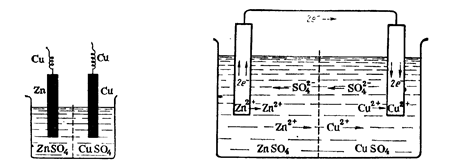
1. Рассмотрим процессы, происходящие на пластинах, когда цепь разомкнута:
Zn – 2e = Zn2+, на цинковой пластинке накапливаются электроны;
Cu – 2e = Cu2+, на медной пластинке тоже накапливаются электроны, но т.к. медь менее активный металл, то на медной пластинке электронов меньше. В системе устанавливается равновесие, т.е. скорость растворения металла равна скорости осаждения
2. При замыкании цепи электроны с цинковой пластинки перетекают на медную, т. к. на цинковой пластинке их больше, при этом равновесие нарушается и для его достижения новые порции цинка будут растворяться. На медной пластине, куда пришли дополнительные электроны с цинка, для установления равновесия начнется процесс осаждения меди.
 Zn – 2e Zn2+, равновесие смещается в сторону растворения цинка;
Zn – 2e Zn2+, равновесие смещается в сторону растворения цинка;
 Cu – 2e Cu2+, равновесие смещается в сторону осаждения меди.
Cu – 2e Cu2+, равновесие смещается в сторону осаждения меди.
Т.о., цинковая пластина начинает растворяться, а на медной пластине начинает осаждаться медь, пока равновесие не восстановится.
Схематично такой гальванический элемент обозначают:



 АZn ZnSO4 CuSO4 Cu K
АZn ZnSO4 CuSO4 Cu K
Электрод, на котором происходит окисление, называется анодом (здесь анод – Zn), электрод, на котором происходит восстановление, называется катодом(Cu).
Электрический ток, протекающий по внешней цепи, может совершать полезную работу: Amax = nFDE. Полезная работа равна произведению количества прошедшего электричества на напряжение, здесь n – число электронов, участвующих в окислительно-восстановительном процессе, F – число Фарадея (F = 96500 Кл/моль), DE – электродвижущая сила гальванического элемента (ЭДС).
ЭДС гальванического элемента - это максимальное значение напряжения гальванического элемента.
DE = Ек – Еа, где Ек – электродный потенциал катода;
Еа – электродный потенциал анода.
Электродные потенциалы возникают на границе раздела фаз – металл – электролит.
Абсолютное значение электродных потенциалов измерить невозможно, поэтому измеряют ЭДС цепи, состоящей из исследуемого электрода и электрода сравнения, потенциал которого условно равен 0. Обычно электродами сравнения служат водородный, каломельный (Hg2Cl2 – Hg) или хлорсеребряный (AgCl –Ag) электрод.
Устройство водородного электрода и электрохимической цепи для измерения ЭДС:
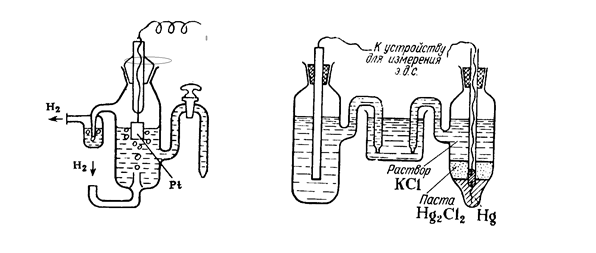
Исследуемый металл может оказаться анодом или катодом.
Рассмотрим два случая:
1). Активные металлы: Zn, Al, Mg.
анодный процесс: Zn – 2e = Zn2+;

 катодный процесс: 2H+ + 2e = H2 .
катодный процесс: 2H+ + 2e = H2 .
А Zn|ZnSO4 ||H2SO4|Pt(H2) K
DE = EK – EA > 0, если EK = 0 Þ EA < 0, т. е. потенциалы активных металлов имеют отрицательные значения.
 2). Предположим, что исследуемый металл неактивен, например медь. Тогда происходит процесс окисления водорода – анодный процесс. Водородный электрод в этом случае будет являться анодом.
2). Предположим, что исследуемый металл неактивен, например медь. Тогда происходит процесс окисления водорода – анодный процесс. Водородный электрод в этом случае будет являться анодом.
 А Pt(H2)|H2SO4 ||CuSO4 |Cu K
А Pt(H2)|H2SO4 ||CuSO4 |Cu K
анодный процесс: H2 – 2e = 2H+;
катодный процесс: Cu2+ + 2e = Cu0.
DE = EK – EА > 0, если EA = 0 Þ EК > 0, т. е. потенциалы неактивных металлов имеют положительные значения.
Таким образом, составляется ряд напряжения металлов. Значения электродных потенциалов относительно водородного потенциала выводятся в таблицу.
Стандартные электродные потенциалы измеряют при стандартных условиях, т.е. концентрации ионов, участвующих в реакции составляет 1 моль/л, давление газов – 101325Па, Т = 2980 К
Стандартные электродные потенциалы обозначаются так: E°[B]. Значения электродных потенциалов зависят от природы металла, от концентрации веществ, участвующих в процессе и от температуры системы. Эта зависимость выражается уравнением Нернста:
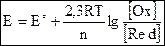
где: Е° – стандартный электродный потенциал;
R – универсальная газовая постоянная ≈ 8,314 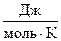 ;
;
Т – абсолютная температура;
n – число электронов, участвующих в окислительно-восстановительном процессе.
[Ox] – концентрация ионов в окисленной форме;
[Red] – концентрация ионов в восстановленной форме.
При подстановке постоянных уравнение принимает вид: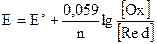 .
.
Для полуреакции окисления металла:
Me° – ne = Men+
Red Ox
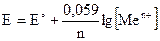 .
.




 Насколько же концентрация влияет на потенциал? Например, в медно-цинковом электроде, где анодом является цинк:
Насколько же концентрация влияет на потенциал? Например, в медно-цинковом электроде, где анодом является цинк:
А Zn ZnSO4 CuSO4Cu К DE0 = 0,34 – (–0,76) = 1,1B.
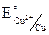 = + 0,34B;
= + 0,34B; 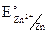 = – 0,76B;
= – 0,76B;
Пусть [ZnSO4] = 0,1 М; [CuSO4] = 0,01 M, тогда
ЭДС = ЕK – EA= 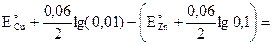 0,34 +0,3∙2 + 0,76 +0,03 =1,07 В.
0,34 +0,3∙2 + 0,76 +0,03 =1,07 В.
Дата добавления: 2015-08-08; просмотров: 665;
