Максимальное заполнение энергетических уровней и подуровней.
| n | N = 2n2 | ℓ | N = 2(2ℓ + 1) | Запись электронного состояния |
| 0(s) | 1s2 | |||
| 0(s) 1(p) | 2s2p6 | |||
| 0(s) 1(p) 2(d) | 3s2p6d10 | |||
| 0(s) 1(p) 2(d) 3(f) | 4s2p6d10f14 | |||
| 0(s) 1(p) 2(d) 3(f) | 5s2p6d10f14 | |||
| 0(s) 1(p) | 6s2p6 |
1. Чтобы правильно составить электронную формулу элемента, нужно определить его положение в таблице Менделеева. Z - заряд ядра, А = Z + N; ē = Z.
2. n – главное квантовое число и, значит, число энергетических уровней, соответствует № периода.
3. № группы соответствует числу валентных электронов (участвующих в образовании связей), причём, если это главная подгруппа (А), то все валентные электроны находятся на верхнем энергетическом уровне. Если это побочная подгруппа, то на внешнем энергетическом уровне находятся 1 или 2 валентных электрона, остальные находятся на предвнешнем энергетическом уровне.
Пример: 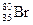 ; n = 1,2 ,3,4; VII A; z = 35;
; n = 1,2 ,3,4; VII A; z = 35; 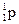 = 35;
= 35; 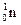 = 45; ē = 35.
= 45; ē = 35.
Br°: 1s22s2p63s2p6d104s2p5 - на последнем энергетическом уровне, находятся валентные электроны.
У десяти элементов побочной подгруппы наблюдается проскок электронов (Cu, Au, Ag, Mo, Cr, Nb, Ru, Rh, Pt, Pd).
Дата добавления: 2015-08-08; просмотров: 1099;
