Ионная связь.
Основные положения современной теории ионной связи:
1.) Ионная связь образуется при взаимодействии элементов, резко отличающихся друг от друга по свойствам, т. е. между металлами и неметаллами.
2.) Образование химической связи объясняется стремлением атомов к достижению устойчивой восьмиэлектронной внешней оболочки (s2p6).
Пример: Na + Cl2 = NaCl2
Na: 1s22s2p63s1 Na0 - 1e = Na+ Na+: 1s22s2p6
Cl: 1s22s2p63s2p5 Cl0 + 1e = Cl- Cl-: 1s22s2p63s2p6
3.) Образовавшиеся разноимённо заряженные ионы удерживаются друг около друга за счёт электростатического притяжения.
4.) Ионная связь не направленная.
5.) Не существует 100%-ной ионной связи, т. е. полностью атомы не отдают свои электроны другому атому.
Пример: Fr+0,93F-0,93 - 93%
 FrF Fr+ + F- - при растворении. Ионная связь - частный случай ковалентной связи.
FrF Fr+ + F- - при растворении. Ионная связь - частный случай ковалентной связи.
Ковалентная связь. Основные положения современной теории ковалентной связи.
1.) Ковалентная связь образуется между элементами, сходными по свойствам, т. е. неметаллами.
2.) Каждый элемент предоставляет для образования связей 1 электрон, причём спины электронов должны быть антипараллельными.
3.) Если ковалентная связь образована атомами одного и того же элемента, то эта связь не полярная, т. е. общая электронная пара не смещена ни к одному из атомов. Если же ковалентная связь образована двумя разными атомам, то общая электронная пара смещена к наиболее электроотрицательному атому, это полярная ковалентная связь.
4.) При образовании ковалентной связи происходит перекрывание электронных облаков взаимодействующих атомов, в результате, в пространстве между атомами возникает зона повышенной электронной плотности, притягивающая к себе положительно заряженные ядра взаимодействующих атомов, и удерживающая их друг от друга
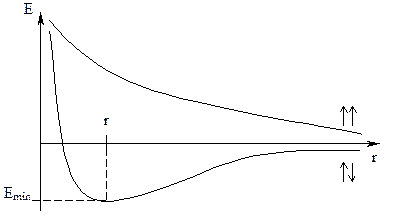
r - расстояние между взаимодействующими векторами.
Для описания ковалентной связи используют 2 метода: метод валентных связей (ВС) и метод молекулярных орбиталей (ММО).
Дата добавления: 2015-08-08; просмотров: 797;
