Периодический закон и периодическая система элементов.
Свойства элементов находятся в периодической зависимости от заряда ядра их атомов.
1. Радиусы атомов. В пределах периода с увеличением порядкового номера элемента, размеры атомов уменьшаются, т. к. увеличивается положительный заряд ядра, а количество энергетических уровней остаётся постоянным. Чем больше заряд ядра, тем сильнее электроны притягиваются к ядру, поэтому радиус атома уменьшается.
В пределах группы, с увеличением порядкового номера, размеры атомов возрастают, т. к. несмотря на увеличение заряда ядра, увеличивается количество энергетических уровней и ослабляется притяжение электронов к ядру.
Радиусы ионов, по сравнению с радиусами атомов могут увеличиваться или уменьшаться, в зависимости от того, принимает атом электрон, или отдаёт.
2. Энергия ионизации или DНион. это то количество энергии, которое необходимо затратить, чтобы оторвать электрон от невозбуждённого атома и удалить его за пределы взаимодействия.
DНион. > 0, причём, каждый последующий электрон отрывается труднее
DН1 < DН2 < DН3 <…< DНn
Величина DНион. характеризует способность элемента отдавать электроны, т. е. характеризует его восстановительные свойства. Чем меньше DНион., тем выше восстановительные свойства элементов. В пределах периода с уменьшением радиуса атомов энергия ионозации увеличивается, а в пределах группы с увеличением радиуса атомов энергия ионизации уменьшается.
3. Энергия сродства к электрону - это энергия, которая выделяется при присоединении электрона к невозбуждённому атому, молекуле или радикалу.
Э + е → Э-, DН < 0 - процесс экзотермический.
В периодах слева направо сродство к электрону увеличивается, а в пределах группы сверху вниз сродство к электрону уменьшается, т. к. увеличивается радиус атома.
Сродство к электрону характеризует окисляющие свойства элемента, т. е. чем больше сродство к электрону, тем более сильным окислителем является элемент. Самым сильным окислителем является F (фтор): 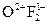 .
.
4. Электроотрицательность. Чтобы учесть и DНион. и DНср-ва, вводят понятие электроотрицательности.
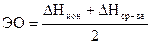 .
.
Электроотрицательность (по Полингу) это способность атома, связанного в молекуле и ионе, притягивать к себе электроны, участвующие в образовании связей.
Вводится шкала электроотрицательности по Полингу:
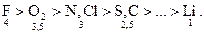
В пределах периода электроотрицательность возрастает слева направо. А в пределах группы электроотрицательность уменьшается сверху вниз.
5. Кислотно-основные свойства оксидов и гидроксидов.
В пределах периода, слева направо возрастают кислотные свойства оксидов и гидроксидов. Рассмотрим, например III период:
NaOH Mg(OH)2 Al(OH)3
щёлочь н/р в воде основание амфотерный гидроксид
H2SiO3 H3PO4 H2SO4 HClO4
слабая кислота средней силы кислота сильная кислота очень сильная кислота
В пределах группы возрастают основные свойства оксидов и гидроксидов. Возьмём IV группу, главную подгруппу:
H2CO3 - кислота;
H2SiO3 - не растворимая в воде кислота;
H2GeO3 ≡ Ge(OH)4 - амфотерный гидроксид, с преобладанием кислотных свойств;
H2SnO3 ≡ Sn(OH)4 - амфотерный гидроксид;
Pb(OH)4 - амфотерный гидроксид, с преобладанием основных свойств.
6. Окислительно-восстановительная способность элемента. См. п. 2 и 3.
Дата добавления: 2015-08-08; просмотров: 1345;
